上海市长宁区2022-2023学年高三下学期二模测试化学试题
试卷更新日期:2023-04-26 类型:高考模拟
一、单选题
-
1. 生活中处处有化学,下列叙述正确的是( )A、铅笔芯的成分为二氧化铅 B、碳酸氢钠可做食品膨松剂 C、青铜和黄铜是不同结构的单质铜 D、焰火中红色来源于钠盐灼烧2. 下列说法错误的是A、电解熔融氯化镁可制取金属镁 B、电解饱和食盐水可制取氯气 C、纯铁比生铁易生锈 D、硫黄或硫铁矿可用于接触法制硫酸3. 下列有关化学用语表示正确的是A、氟原子的结构示意图:
 B、质子数为53中子数为78的碘原子:
C、硫化钠的电子式:
B、质子数为53中子数为78的碘原子:
C、硫化钠的电子式: D、明矾的化学式:Al2(SO4)3
4. 下列过程中共价键被破坏的是( )A、氯气溶于水 B、碘升华 C、乙醇溶于水 D、NaOH溶于水5. 苯是不饱和烃,不能使溴的四氯化碳溶液褪色,是因为A、苯能溶于四氯化碳 B、苯是非极性分子 C、苯能发生取代反应 D、苯中不存在烯烃典型的碳碳双键6. 下列说法错误的是A、乙醇和丙三醇互为同系物 B、和互为同位素 C、和互为同素异形体 D、丙酮(
D、明矾的化学式:Al2(SO4)3
4. 下列过程中共价键被破坏的是( )A、氯气溶于水 B、碘升华 C、乙醇溶于水 D、NaOH溶于水5. 苯是不饱和烃,不能使溴的四氯化碳溶液褪色,是因为A、苯能溶于四氯化碳 B、苯是非极性分子 C、苯能发生取代反应 D、苯中不存在烯烃典型的碳碳双键6. 下列说法错误的是A、乙醇和丙三醇互为同系物 B、和互为同位素 C、和互为同素异形体 D、丙酮( )和环氧丙烷(
)和环氧丙烷( )互为同分异构体
7. 100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法错误的是A、焦硫酸具有强吸水性 B、焦硫酸具有强氧化性 C、焦硫酸可与碱反应生成盐和水 D、100%硫酸吸收SO3生成焦硫酸的变化是物理变化8. 侯氏制碱法中没有用到的原料是( )A、CaO B、NaCl C、NH3 D、CO29. 关于化合物2−苯基丙烯(
)互为同分异构体
7. 100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法错误的是A、焦硫酸具有强吸水性 B、焦硫酸具有强氧化性 C、焦硫酸可与碱反应生成盐和水 D、100%硫酸吸收SO3生成焦硫酸的变化是物理变化8. 侯氏制碱法中没有用到的原料是( )A、CaO B、NaCl C、NH3 D、CO29. 关于化合物2−苯基丙烯(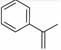 ),下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯10. 下列反应不属于离子反应的是( )A、乙醇与乙酸 B、氨水与醋酸 C、碳酸钙与盐酸 D、氯化铁溶液与硫氰化钾溶液11. 下列有关性质的比较,不能用元素周期律解释的是( )A、酸性:H2SO4>HClO B、金属性:Mg>Al C、碱性:NaOH>LiOH D、稳定性:CH4>SiH412. 常温下,下列溶液中水的电离程度最大的是( )A、pH=0的硫酸 B、0.01mol/L NaOH溶液 C、pH=10的纯碱溶液 D、pH=5的氯化铵溶液13. 除去下列物质中所含的少量杂质(括号内为杂质),所用除杂试剂合理的是A、FeCl3溶液(CuCl2)铁粉 B、C2H6(C2H4):H2/催化剂 C、CO2(SO2):酸性高锰酸钾溶液 D、乙醛(乙酸):饱和碳酸钠溶液14. 下列实验方案中不能达到实验目的的是
),下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯10. 下列反应不属于离子反应的是( )A、乙醇与乙酸 B、氨水与醋酸 C、碳酸钙与盐酸 D、氯化铁溶液与硫氰化钾溶液11. 下列有关性质的比较,不能用元素周期律解释的是( )A、酸性:H2SO4>HClO B、金属性:Mg>Al C、碱性:NaOH>LiOH D、稳定性:CH4>SiH412. 常温下,下列溶液中水的电离程度最大的是( )A、pH=0的硫酸 B、0.01mol/L NaOH溶液 C、pH=10的纯碱溶液 D、pH=5的氯化铵溶液13. 除去下列物质中所含的少量杂质(括号内为杂质),所用除杂试剂合理的是A、FeCl3溶液(CuCl2)铁粉 B、C2H6(C2H4):H2/催化剂 C、CO2(SO2):酸性高锰酸钾溶液 D、乙醛(乙酸):饱和碳酸钠溶液14. 下列实验方案中不能达到实验目的的是 A、用装置①测量盐酸和氢氧化钠溶液反应前后的温度 B、用装置②除去Cl2中少量的HCl气体 C、用装置③可以说明氨气极易溶于水 D、用装置④检验1-溴丁烷和氢氧化钠乙醇溶液反应的产物15. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
A、用装置①测量盐酸和氢氧化钠溶液反应前后的温度 B、用装置②除去Cl2中少量的HCl气体 C、用装置③可以说明氨气极易溶于水 D、用装置④检验1-溴丁烷和氢氧化钠乙醇溶液反应的产物15. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是 A、钢铁设施表面因积累大量电子而被保护 B、金属M的活动性比Fe的活动性弱 C、阴极的电极反应式为 D、钢铁设施在河水中的腐蚀速率比在海水中的快16. 氢化铵与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述中正确的是A、NH4H是共价化合物 B、NH4H溶于水所形成的溶液显酸性 C、NH4H固体投入少量的水中有两种气体产生 D、NH4H与水反应时,NH4H是氧化剂17. 常温常压下,1mol CH3OH与O2发生反应时,生成CO或HCHO的能量变化如图(反应物O2和生成物水略去),下列说法正确的是
A、钢铁设施表面因积累大量电子而被保护 B、金属M的活动性比Fe的活动性弱 C、阴极的电极反应式为 D、钢铁设施在河水中的腐蚀速率比在海水中的快16. 氢化铵与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述中正确的是A、NH4H是共价化合物 B、NH4H溶于水所形成的溶液显酸性 C、NH4H固体投入少量的水中有两种气体产生 D、NH4H与水反应时,NH4H是氧化剂17. 常温常压下,1mol CH3OH与O2发生反应时,生成CO或HCHO的能量变化如图(反应物O2和生成物水略去),下列说法正确的是 A、加入催化剂后,生成CO的热效应变大,生成HCHO的热效应变小 B、加入催化剂后,生成HCHO的速率变大,单位时间内生成HCHO量变多 C、1mol CH3OH完全燃烧生成液态水和二氧化碳(g)放出393kJ的热量 D、生成HCHO的热化学方程式为2CH3OH+O2=2HCHO+2H2O+316kJ18. 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是A、生成12.7g I2时,转移0.1mol电子 B、KI是还原产物 C、还原剂与氧化剂的物质的量之比为7:1 D、K2H3IO6发生氧化反应19. 温度为T℃,向体积不等的恒容密闭容器中均充入1mol气体X,发生反应:X(g)⇌Y(g)+Z(g)ΔH,反应均进行10min,测得各容器中X的转化率与容器体积的关系如图所示。下列说法正确的是
A、加入催化剂后,生成CO的热效应变大,生成HCHO的热效应变小 B、加入催化剂后,生成HCHO的速率变大,单位时间内生成HCHO量变多 C、1mol CH3OH完全燃烧生成液态水和二氧化碳(g)放出393kJ的热量 D、生成HCHO的热化学方程式为2CH3OH+O2=2HCHO+2H2O+316kJ18. 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是A、生成12.7g I2时,转移0.1mol电子 B、KI是还原产物 C、还原剂与氧化剂的物质的量之比为7:1 D、K2H3IO6发生氧化反应19. 温度为T℃,向体积不等的恒容密闭容器中均充入1mol气体X,发生反应:X(g)⇌Y(g)+Z(g)ΔH,反应均进行10min,测得各容器中X的转化率与容器体积的关系如图所示。下列说法正确的是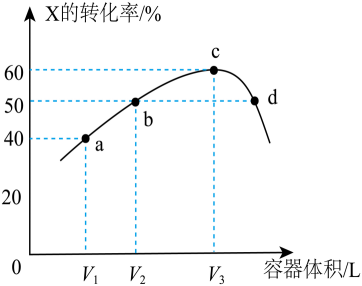 A、a点再充入一定量的X,X的转化率减小 B、d点有ν正=ν逆 C、正反应速率v(b)=v(d) D、若c点为平衡点,则浓度平衡常数K=0.920. 下列离子方程式正确的是A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO+H2O=2HCO B、酸性条件下KIO3溶液与KI溶液反应生成I2:5I-+IO+3H2O=3I2+6OH- C、向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO恰好完全反应:2Ba2++4OH-+Al3++2SO=BaSO4↓+AlO+2H2O D、NH4HSO3溶液中逐滴加入足量的Ba(OH)2溶液:NH+HSO+Ba2++2OH-=BaSO3↓+NH3·H2O+H2O
A、a点再充入一定量的X,X的转化率减小 B、d点有ν正=ν逆 C、正反应速率v(b)=v(d) D、若c点为平衡点,则浓度平衡常数K=0.920. 下列离子方程式正确的是A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO+H2O=2HCO B、酸性条件下KIO3溶液与KI溶液反应生成I2:5I-+IO+3H2O=3I2+6OH- C、向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO恰好完全反应:2Ba2++4OH-+Al3++2SO=BaSO4↓+AlO+2H2O D、NH4HSO3溶液中逐滴加入足量的Ba(OH)2溶液:NH+HSO+Ba2++2OH-=BaSO3↓+NH3·H2O+H2O二、非选择题
-
21. 1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。[BrOF2][AsF6]•xKrF2是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,回答下列问题:(1)、As元素原子序数为33,在周期表中的位置是。As原子的价电子排布式为。与磷酸相比,最高价氧化物的水化物酸性强弱的顺序是:。(2)、Ar、Kr、Xe原子半径大小顺序为。Ar、Kr、Xe原子的活泼性依序增强,原因是。(3)、晶体熔点:KrF2XeF2(填“>”“<”或“=”),判断依据是。(4)、试猜想:[BrOF2][AsF6]•xKrF2晶体中的化学键类型有。
三、原理综合题
-
22. CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2 , S8受热分解成气态S2 , 发生反应2S2(g)+CH4(g)CS2(g)+2H2S(g),回答下列问题:(1)、CH4的立体构型为 , CS2分子的电子式为。(2)、某温度下若S8完全分解成气态S2。在恒温恒容密闭容器中S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数
(3)、一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃可能的原因是:。 (4)、用燃煤废气(含N2、O2、SO2、CO2、H2O等)使尾气中的H2S转化为单质硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。燃煤废气中常含有的NOx也能使H2S转化为单质硫S,完成其化学方程式,并标出电子转移的方向和数目(用含X的代数式表示)。
(4)、用燃煤废气(含N2、O2、SO2、CO2、H2O等)使尾气中的H2S转化为单质硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。燃煤废气中常含有的NOx也能使H2S转化为单质硫S,完成其化学方程式,并标出电子转移的方向和数目(用含X的代数式表示)。H2S+ NOx= S+ + N2
四、有机推断题
-
23. 基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。以化合物I为原料,可合成丙烯酸V、丙醇VII等化工产品,进而可制备聚丙烯酸丙酯类高分子材料。
 (1)、化合物I的分子式为 , 其环上的取代基是(写名称)。(2)、已知化合物II也能以II′的形式存在。根据II′的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。
(1)、化合物I的分子式为 , 其环上的取代基是(写名称)。(2)、已知化合物II也能以II′的形式存在。根据II′的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。序号
结构特征
可反应的试剂
反应形成的新结构
反应类型
①
-CH=CH-
H2
-CH2-CH2-
②
氧化反应
③
取代反应
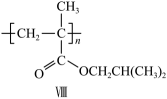
(3)、化合物IV到化合物V的反应是原子利用率100%的反应,且1molIV与1mol化合物a反应得到2molV,则化合物a为。化合物VI有多种同分异构体,其中含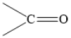 结构的有种,分子中只有1种化学环境氢原子的结构简式为。
结构的有种,分子中只有1种化学环境氢原子的结构简式为。
 (4)、选用含两个羧基的化合物作为唯一的含氧有机原料,参考上述信息,制备高分子化合物VIII的单体。写出VIII的单体的合成路线(不用注明反应条件)。(合成路线常用的表达方式为:A……B目标产物)
(4)、选用含两个羧基的化合物作为唯一的含氧有机原料,参考上述信息,制备高分子化合物VIII的单体。写出VIII的单体的合成路线(不用注明反应条件)。(合成路线常用的表达方式为:A……B目标产物)五、实验题
-
24. 溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末,常用作有机反应的催化剂。实验室制备CuBr的实验步骤和装置如图。

 (1)、实验所用蒸馏水需经煮沸,煮沸目的是除去蒸馏水中的 (写化学式); 三颈烧瓶中反应生成CuBr的离子方程式为;控制反应在60℃进行,实验中可采取的措施是 ;说明反应已完成的现象是 。(2)、步骤②抽滤需要避光的原因是 , 步骤③依次用溶有少量SO2的水、溶有少量SO2的乙醇、极易挥发的乙醚洗涤,洗涤剂需“溶有SO2”的原因是 ;最后用乙醚的目的可能是。(3)、将产品在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。本实验产品的产率是(保留小数点后1位)。(4)、欲利用上述装置烧杯中的吸收液(经检测主要含有Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。完善下列步骤:①在烧杯中继续通入SO2至恰好反应完全;②向烧杯中加入g 20% NaOH;③加入少量维生素C溶液作抗氧化剂;④通过蒸发浓缩、、过滤、用乙醇洗涤2~3次;⑤置于真空干燥箱中干燥。
(1)、实验所用蒸馏水需经煮沸,煮沸目的是除去蒸馏水中的 (写化学式); 三颈烧瓶中反应生成CuBr的离子方程式为;控制反应在60℃进行,实验中可采取的措施是 ;说明反应已完成的现象是 。(2)、步骤②抽滤需要避光的原因是 , 步骤③依次用溶有少量SO2的水、溶有少量SO2的乙醇、极易挥发的乙醚洗涤,洗涤剂需“溶有SO2”的原因是 ;最后用乙醚的目的可能是。(3)、将产品在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。本实验产品的产率是(保留小数点后1位)。(4)、欲利用上述装置烧杯中的吸收液(经检测主要含有Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。完善下列步骤:①在烧杯中继续通入SO2至恰好反应完全;②向烧杯中加入g 20% NaOH;③加入少量维生素C溶液作抗氧化剂;④通过蒸发浓缩、、过滤、用乙醇洗涤2~3次;⑤置于真空干燥箱中干燥。
-
-
-