上海市虹口区2022~2023学年高三下学期二模测试化学试题
试卷更新日期:2023-04-26 类型:高考模拟
一、单选题
-
1. 用铜锌合金制成的黄铜制品常被误认为黄金。下列关于黄铜的说法错误的是A、有金属光泽 B、熔点比锌高 C、硬度比铜大 D、可用稀盐酸鉴别黄铜与黄金2. 铼(75Re)是广泛用于航空发动机涡轮叶片的稀土元素。从此信息中不能确定的是A、铼原子的质量数 B、铼元素的原子序数 C、铼原子核外电子排布 D、铼元素在元素周期表中位置3. 下列属于含有非极性键的强电解质的是A、HBr B、Na2O2 C、KOH D、NH4Cl4. 下列常用实验室仪器中,一般不用于混合物分离或提纯的是( )A、
 B、
B、 C、
C、 D、
D、 5. 在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的( )A、原子数 B、分子数 C、质量 D、电子数6. 将足量SO2气体通入BaCl2溶液中,无明显现象。若要观察到BaSO3沉淀,可再通入A、Cl2 B、NO2 C、H2S D、NH37. 下列有关CH2=CH-CH=CH2说法错误的是A、所有原子可能处于同一平面上 B、与溴的加成产物共有2种 C、与异戊二烯互为同系物 D、属于炔烃类的同分异构体有2种8. 下列物质性质的变化规律与化学键强弱无关的是A、HF、HCl、HBr的热稳定性依次减弱 B、NaF、NaCl、NaBr的熔点依次降低 C、Li、Na、K的熔点逐渐降低 D、SiF4、SiCl4、SiBr4的熔、沸点逐渐升高9. 短周期主族元素W、X、Y、Z、Q原子序数依次增大。W与Q同主族,且Q的原子序数是W的2倍;X的简单离子在同周期元素形成的简单离子中半径最小。下列说法正确的是A、元素最高正价:W = Q B、原子半径:W>X C、核外未成对电子数:Y = Q D、非金属性:Y>Z10. 下列化工生产中,所采取的条件或操作不能用勒夏特列原理解释的是A、工业制盐酸:向合成塔中通入过量氢气 B、合成氨:采用20-50MPa压强 C、工业制硫酸:向接触室中通入过量空气 D、联合制碱工业:向母液中加入食盐11. 下列离子方程式正确的是A、氨气溶于醋酸溶液:NH3+H+=NH B、碳酸钙与稀盐酸反应:CO+2H+=CO2↑+H2O C、硫酸铜溶液与氢氧化钡溶液反应:SO+Ba2+=BaSO4↓ D、向氯化铜溶液中通入硫化氢气体:Cu2++H2S=CuS↓+2H+12. 对如图所示的实验装置的判断错误的是
5. 在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的( )A、原子数 B、分子数 C、质量 D、电子数6. 将足量SO2气体通入BaCl2溶液中,无明显现象。若要观察到BaSO3沉淀,可再通入A、Cl2 B、NO2 C、H2S D、NH37. 下列有关CH2=CH-CH=CH2说法错误的是A、所有原子可能处于同一平面上 B、与溴的加成产物共有2种 C、与异戊二烯互为同系物 D、属于炔烃类的同分异构体有2种8. 下列物质性质的变化规律与化学键强弱无关的是A、HF、HCl、HBr的热稳定性依次减弱 B、NaF、NaCl、NaBr的熔点依次降低 C、Li、Na、K的熔点逐渐降低 D、SiF4、SiCl4、SiBr4的熔、沸点逐渐升高9. 短周期主族元素W、X、Y、Z、Q原子序数依次增大。W与Q同主族,且Q的原子序数是W的2倍;X的简单离子在同周期元素形成的简单离子中半径最小。下列说法正确的是A、元素最高正价:W = Q B、原子半径:W>X C、核外未成对电子数:Y = Q D、非金属性:Y>Z10. 下列化工生产中,所采取的条件或操作不能用勒夏特列原理解释的是A、工业制盐酸:向合成塔中通入过量氢气 B、合成氨:采用20-50MPa压强 C、工业制硫酸:向接触室中通入过量空气 D、联合制碱工业:向母液中加入食盐11. 下列离子方程式正确的是A、氨气溶于醋酸溶液:NH3+H+=NH B、碳酸钙与稀盐酸反应:CO+2H+=CO2↑+H2O C、硫酸铜溶液与氢氧化钡溶液反应:SO+Ba2+=BaSO4↓ D、向氯化铜溶液中通入硫化氢气体:Cu2++H2S=CuS↓+2H+12. 对如图所示的实验装置的判断错误的是 A、开关K置于A处时,可减缓铁的腐蚀 B、开关K置于A处时,铁棒表面有氢气产生 C、开关K置于B处时,铁棒一定为负极 D、开关K置于B处时,可通过牺牲阳极的阴极保护法减缓铁的腐蚀13. 下列关于聚合物A(
A、开关K置于A处时,可减缓铁的腐蚀 B、开关K置于A处时,铁棒表面有氢气产生 C、开关K置于B处时,铁棒一定为负极 D、开关K置于B处时,可通过牺牲阳极的阴极保护法减缓铁的腐蚀13. 下列关于聚合物A( )和B(
)和B( )的说法正确的是 A、互为同分异构体 B、都具有较好的水溶性 C、都能用乳酸(
)的说法正确的是 A、互为同分异构体 B、都具有较好的水溶性 C、都能用乳酸( )制备
D、都可在碱性条件下降解为小分子
14. 某同学想要用如图装置制备氨气并验证氨气的某些化学性质,其设计具有合理性的部分是
)制备
D、都可在碱性条件下降解为小分子
14. 某同学想要用如图装置制备氨气并验证氨气的某些化学性质,其设计具有合理性的部分是 A、用装置甲制取氨气 B、用装置乙干燥氨气 C、用装置丙验证氨气具有还原性 D、用装置丁可以防倒吸15. 某同学为检验溶液中是否含有常见的四种离子,进行了如图操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。下列结论正确的是
A、用装置甲制取氨气 B、用装置乙干燥氨气 C、用装置丙验证氨气具有还原性 D、用装置丁可以防倒吸15. 某同学为检验溶液中是否含有常见的四种离子,进行了如图操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。下列结论正确的是 A、原溶液中一定含有 B、原溶液中一定含有 C、原溶液中一定含有 D、原溶液中一定含有16. 气态有机物①~④分别与氢气发生加成反应生成1mol气态环己烷(
A、原溶液中一定含有 B、原溶液中一定含有 C、原溶液中一定含有 D、原溶液中一定含有16. 气态有机物①~④分别与氢气发生加成反应生成1mol气态环己烷( )的能量变化如图所示。下列说法错误的是
)的能量变化如图所示。下列说法错误的是 A、物质的热稳定性:②<③ B、物质④中不存在碳碳双键 C、物质①~④与氢气的加成反应都是放热反应 D、物质③脱氢生成④的热化学方程式为:
A、物质的热稳定性:②<③ B、物质④中不存在碳碳双键 C、物质①~④与氢气的加成反应都是放热反应 D、物质③脱氢生成④的热化学方程式为: (g)
(g) (g)+H2(g)-21kJ
17. 某同学为测定某NaHCO3(含少量NaCl)固体中NaHCO3的含量,设计如下实验。
(g)+H2(g)-21kJ
17. 某同学为测定某NaHCO3(含少量NaCl)固体中NaHCO3的含量,设计如下实验。
下列说法错误的是
A、NaHCO3的质量分数为: B、可通过恒重操作确保固体完全烘干 C、反应的离子方程式为:HCO+Ba2++OH-=BaCO3↓+H2O D、确定Ba(OH)2是否过量的操作:取上层清液,继续加Ba(OH)2溶液,看有无沉淀生成18. 某兴趣小组对氢氧化镁的溶解进行如图探究实验。下列说法错误的是 A、c(OH-):①=③ B、③中存在:2c(Mg2+)>c(Cl-) C、③中溶液又变红的原因:沉淀溶解平衡正向移动 D、①中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)19. 一定温度下,向1L密闭容器中充入2molX和1molY,发生反应2X(g)+Y(g)⇌3Z(?)。达到平衡时,容器的压强从原来的P0变为0.4P0。下列说法错误的是A、Z不可能为气体 B、达到平衡时容器内有1.8molZ C、压缩体积,再次达到平衡,X的浓度不变 D、Y的体积分数不变说明反应达到平衡状态20. 向100mL1mol·L-1NH4Al(SO4)2溶液中逐滴加入1mol·L-1Ba(OH)2溶液。沉淀总物质的量n随加入Ba(OH)2溶液体积V的变化如图。下列说法错误的是
A、c(OH-):①=③ B、③中存在:2c(Mg2+)>c(Cl-) C、③中溶液又变红的原因:沉淀溶解平衡正向移动 D、①中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)19. 一定温度下,向1L密闭容器中充入2molX和1molY,发生反应2X(g)+Y(g)⇌3Z(?)。达到平衡时,容器的压强从原来的P0变为0.4P0。下列说法错误的是A、Z不可能为气体 B、达到平衡时容器内有1.8molZ C、压缩体积,再次达到平衡,X的浓度不变 D、Y的体积分数不变说明反应达到平衡状态20. 向100mL1mol·L-1NH4Al(SO4)2溶液中逐滴加入1mol·L-1Ba(OH)2溶液。沉淀总物质的量n随加入Ba(OH)2溶液体积V的变化如图。下列说法错误的是 A、沉淀质量:b点>a点>c点 B、a点到c点过程中,b点溶液中水的电离程度最小 C、a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-] D、b点到c点过程中,发生的离子方程式为:Al(OH)3+OH-=AlO+2H2O
A、沉淀质量:b点>a点>c点 B、a点到c点过程中,b点溶液中水的电离程度最小 C、a点离子浓度的大小关系为:[NH]>[SO]>[H+]>[OH-] D、b点到c点过程中,发生的离子方程式为:Al(OH)3+OH-=AlO+2H2O二、综合题
-
21. SO2是大气污染物,SO2废气的处理可以先用H2还原成H2S后再设法回收S,主要涉及反应:3H2+SO2H2S+2H2O。完成下列填空:(1)、写出硫化氢的电子式 , 硫原子的核外有种不同运动状态的电子。(2)、列举一个硫元素比氧元素非金属性弱的事实:。(3)、在一定温度下,向2L反应器中通入含SO2的废气与H2 , 经过10min,有0.4mol水生成,则这段时间内v(SO2)=。(4)、一定条件下SO2与H2的反应达到平衡时,SO2的平衡转化率随温度(t)、压强(P)的变化如下图所示:
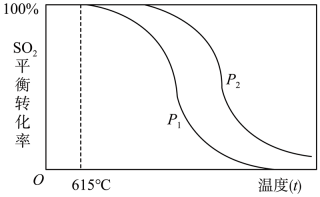
①根据上述信息可以判断:P1P2(填“>”、“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K将(填“变大”、“变小”或“不变”)。
③SO2废气的另一种处理方法是用Na2SO3溶液吸收,得到NaHSO3溶液。
(5)、写出该方法吸收SO2的化学方程式。(6)、所得的NaHSO3溶液呈酸性,运用相关化学用语进行解释。22. 铁及其化合物在人类生活中有着极其重要的作用。完成下列填空:(1)、铁的原子结构示意图为 。由此可知,铁是第周期元素,铁原子核外3d轨道上共填充了个电子。 (2)、古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是(选填编号)。
。由此可知,铁是第周期元素,铁原子核外3d轨道上共填充了个电子。 (2)、古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是(选填编号)。a.Fe b.FeO c.Fe2O3 d.Fe3O4
(3)、FeSO4可以用来净水、治疗缺铁性贫血等,实验室在配制FeSO4溶液时,为了防止FeSO4变质,经常向溶液中加入铁粉,其原因是(用离子方程式表示)。(4)、向新配制的FeSO4溶液中,加入一定量的稀硝酸,发生如下反应:Fe2++H++NO=Fe3++NO↑+H2O
①配平上述反应。
②每生成0.5molNO气体,转移的电子数为。
③要检验该反应后的溶液中是否还含有Fe2+ , 实验方案是。
现在可以利用铁氧化物循环裂解水制备氢气,其过程如图所示:
 (5)、写出反应Ⅲ的平衡常数表达式。(6)、写出铁氧化物循环裂解水制氢的总反应的化学方程式:。(7)、Fe3O4和CO的反应过程与温度密切相关。向某容器中加入Fe3O4与CO,当其它条件一定时,达到平衡时CO的体积百分含量随温度的变化关系如图所示。
(5)、写出反应Ⅲ的平衡常数表达式。(6)、写出铁氧化物循环裂解水制氢的总反应的化学方程式:。(7)、Fe3O4和CO的反应过程与温度密切相关。向某容器中加入Fe3O4与CO,当其它条件一定时,达到平衡时CO的体积百分含量随温度的变化关系如图所示。
已知:①Fe3O4+CO⇌3FeO+CO2-Q1(Q1>0)
②Fe3O4+4CO⇌3Fe+4CO2+Q2(Q2>0)
推测当温度达到570℃,平衡时CO体积百分含量最高的原因:。
23. 某同学查阅资料得知,无水三氯化铝能催化乙醇制备乙烯,为探究适宜的反应温度,设计如下反应装置:
检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
(1)、仪器B的名称是;该实验所采用的加热方式优点是 , 液体X可能是(选填编号)。a.水 b.酒精 c.油 d.乙酸
(2)、根据实验结果,判断适宜的反应温度为。(3)、在140℃进行实验,长时间反应未观察到C中溶液褪色,可能的原因是。(4)、在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是。(5)、教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有、(列举两点)。(6)、品溶解后配成500mL溶液,量取25.00mL置于锥形瓶中,用浓度为0.1000mol·L-1的AgNO3标准溶液进行滴定,达到终点时消耗标准液15.30mL。该样品中AlCl3的质量分数为(保留3位有效数字)。
(7)、某次测定结果误差为-2.1%,可能会造成此结果的原因是(选填编号)。a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质
24. 贝沙罗汀(分子式C24H28O2)主要用于治疗顽固性早期皮肤T细胞淋巴瘤,其一种合成路线如下:
完成下列填空:
(1)、①的反应类型是;③所需的无机试剂是;④中官能团的转化为:→(填官能团名称)。(2)、②的反应式为。(3)、已知:1molC与1molD反应生成1molE,同时生成1molHCl。D的结构简式为。(4)、写出满足下列条件的A的一种同分异构体的结构简式。i.属于芳香族化合物,能发生银镜反应
ⅱ.只含有2种化学环境不同的氢原子
(5)、参考E→F的反应信息,写出以 为原料合成
为原料合成 的路线。(无机试剂与溶剂任选,合成路线常用的表示方式为:A……B目标产物)
的路线。(无机试剂与溶剂任选,合成路线常用的表示方式为:A……B目标产物)