重庆市普通高等学校2023年招生统一考试样卷化学试题
试卷更新日期:2023-04-26 类型:高考模拟
一、单选题
-
1. “筑梦冰雪,同向未来”,2022年北京冬奥会圆满落幕。下列说法错误的是A、吉祥物“冰墩墩”用聚酯纤维作填充物,聚酯纤维属于天然有机高分子材料 B、速滑馆“冰丝带”用二氧化碳作制冷剂,二氧化碳是共价化合物 C、大跳台“雪飞天”用钢作主体结构,钢属于合金 D、火炬“飞扬”用氢气作燃料,氢气是清洁能源2. 下列叙述正确的是A、Na和Mg均可与冷水剧烈反应 B、和均可使品红溶液永久褪色 C、盐酸和NaOH溶液均可与Al反应生成 D、浓硝酸和稀硝酸均可与Cu反应生成3. 室温下,经指定操作后,下列各组溶液中离子还能大量共存的是A、加入:、、、 B、加入:、、、 C、加入:、、、 D、加入:、、、4. “张—烯炔环异构化反应”可合成五元环状化合物(如下所示),在生物活性分子和药物分子的合成中有重要应用。

下列说法错误的是
A、X中含有四种官能团 B、Y中碳氧之间有5个σ键 C、X与Y均可使酸性高锰酸钾溶液褪色 D、等质量的X与Y分别完全燃烧所需氧气的质量不同5. 三星堆遗址出土了大量的青铜器,其主要成分为Cu、Sn、Pb,还含少量Fe、As、O等元素。对上述有关元素,下列说法正确的是A、基态Cu原子的价层电子轨道表示式为 B、基态Fe原子最高能级的轨道形状为哑铃形
C、第一电离能最大的是As
D、电负性最大的是O
6. 已知:。代表阿伏加德罗常数的值,下列说法错误的是A、生成电子转移数为 B、消耗生成CO分子数为 C、生成标准状况下 , 断开C-H键数为 D、消耗所生成的气体完全燃烧,需要分子数为7. 下列实验装置(夹持和加热装置略)及操作正确的是
B、基态Fe原子最高能级的轨道形状为哑铃形
C、第一电离能最大的是As
D、电负性最大的是O
6. 已知:。代表阿伏加德罗常数的值,下列说法错误的是A、生成电子转移数为 B、消耗生成CO分子数为 C、生成标准状况下 , 断开C-H键数为 D、消耗所生成的气体完全燃烧,需要分子数为7. 下列实验装置(夹持和加热装置略)及操作正确的是



A.验证CO还原性
B.制备
C.测定原电池电压
D.干燥乙醇
A、A B、B C、C D、D8. 为达到实验目的,下列实验操作错误的是选项
实验操作
实验目的
A
将和分别通入溴的四氯化碳溶液
和的鉴别
B
将盛有NaCl溶液的烧杯置于酒精灯上蒸发浓缩
NaCl的结晶
C
将苯与碘水在分液漏斗中充分振荡混匀、静置
萃取单质
D
将充满且塞有橡胶塞的试管倒立在水中,打开胶塞
验证溶解性
A、A B、B C、C D、D9. R、X、Y、Z均为短周期元素,R与X同族,X的原子半径在这四种元素中是最小的,和均达到了8电子稳定结构,R的原子序数大于Z,Y原子的最外层电子数为Z原子与X原子的最外层电子数之差。下列叙述正确的是A、R的氯化物水溶液呈酸性 B、X的单质还原性比R的单质强 C、Y位于第三周期第VIA族 D、Z的原子半径比Y小10. 将溶液与0.1mol/LHCl溶液等体积混合(忽略温度变化),下列说法正确的是A、混合溶液中 B、混合后的水解常数增大 C、混合溶液中 D、混合后加入适量固体,的电离平衡向右移动11. 是国际公认的绿色消毒剂,在光照下发生反应: , 下列说法正确的是A、是极性分子 B、是直线形分子 C、中的O是杂化 D、HCl气体分子之间存在氢键12. 如图所示是氧化锆晶胞,其结构为立方体,氧化锆的摩尔质量为 , 若阿伏加德罗常数的值为 , 下列说法正确的是 A、立方氧化锆的化学式为ZrO B、每个Zr原子周围有8个O原子 C、氧化锆晶体密度的计算式为 D、相邻两个氧原子之间的最短距离为13. 溶液中某光学活性卤化物的消旋反应为:。某温度下X和Y的浓度随时间的变化曲线如图所示。
A、立方氧化锆的化学式为ZrO B、每个Zr原子周围有8个O原子 C、氧化锆晶体密度的计算式为 D、相邻两个氧原子之间的最短距离为13. 溶液中某光学活性卤化物的消旋反应为:。某温度下X和Y的浓度随时间的变化曲线如图所示。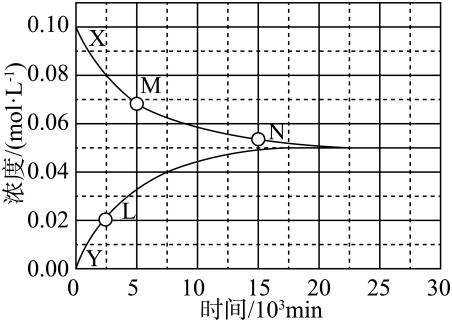
下列说法错误的是
A、 B、L点处X的转化率为20% C、时, D、Y溶液含有少量X,经足够长时间后14. 液态金属电池在规模储能领域具有重要的应用前景。某可充电液态金属电池放电时的工作原理如图所示,电池采用了三层液态设计,其三层液体因密度差和互不混溶而自动分层:隔膜为法拉第选择性膜,该膜既有电子通道,又有离子通道(除外)。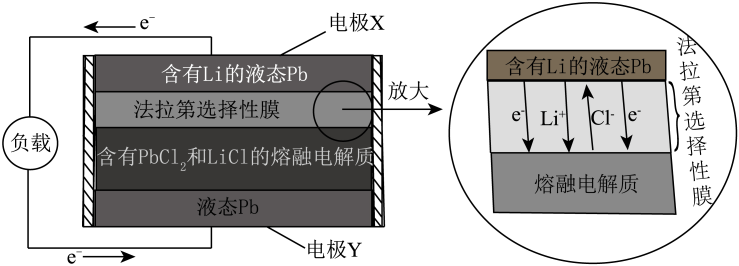
下列说法错误的是
A、放电时电极Y为正极 B、充电时阴极反应式为 C、放电时外电路转移2mol电子,得到Pb的总物质的量为1mol D、法拉第选择性膜避免了直接接触Li而导致充放电性能下降二、非选择题
-
15. 高纯度六氟磷酸锂()是锂离子电池的常用电解液锂盐。HF合成高纯的绿色低温工艺如下。
 (1)、中基态的电子排布式为 , 中P原子上的孤电子对数为。(2)、反应釜1中生成的在反应釜2中转化为LiF沉淀,其反应的离子方程式为。本工艺未采用(工业级)与氢氟酸直接反应制备LiF的原因是。(3)、为提高原料的利用率,本工艺将反应釜4与5串联。向反应釜4和5中加入LiF溶液后,将反应釜3中生成的气体通入反应釜5中,发生反应得到 , 其化学反应方程式为;再将剩余的气体通入反应釜4中发生反应,尾气经水吸收得到的主要副产品是。(4)、遇水易发生水解反应,生成等,其化学反应方程式为。(5)、某温度下, , 不考虑水解,饱和水溶液中的浓度为mol/L。16. 一维结构氧化钇()在光学和陶瓷等领域有重要用途。研究小组制备该的实验过程如下所示。
(1)、中基态的电子排布式为 , 中P原子上的孤电子对数为。(2)、反应釜1中生成的在反应釜2中转化为LiF沉淀,其反应的离子方程式为。本工艺未采用(工业级)与氢氟酸直接反应制备LiF的原因是。(3)、为提高原料的利用率,本工艺将反应釜4与5串联。向反应釜4和5中加入LiF溶液后,将反应釜3中生成的气体通入反应釜5中,发生反应得到 , 其化学反应方程式为;再将剩余的气体通入反应釜4中发生反应,尾气经水吸收得到的主要副产品是。(4)、遇水易发生水解反应,生成等,其化学反应方程式为。(5)、某温度下, , 不考虑水解,饱和水溶液中的浓度为mol/L。16. 一维结构氧化钇()在光学和陶瓷等领域有重要用途。研究小组制备该的实验过程如下所示。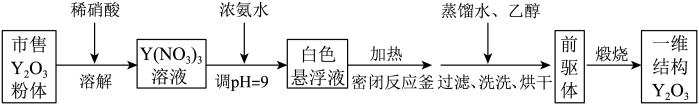 (1)、配制100mL2mol/L硝酸需用到的玻璃仪器有____。A、烧杯 B、量筒 C、温度计 D、玻璃棒 E、漏斗(2)、滴加浓氨水时,用pH试纸测试的具体操作为。(3)、洗涤时,先用蒸馏水后用乙醇的目的是。(4)、探究前驱体化学组成的实验装置如图所示(夹持装置略)。
(1)、配制100mL2mol/L硝酸需用到的玻璃仪器有____。A、烧杯 B、量筒 C、温度计 D、玻璃棒 E、漏斗(2)、滴加浓氨水时,用pH试纸测试的具体操作为。(3)、洗涤时,先用蒸馏水后用乙醇的目的是。(4)、探究前驱体化学组成的实验装置如图所示(夹持装置略)。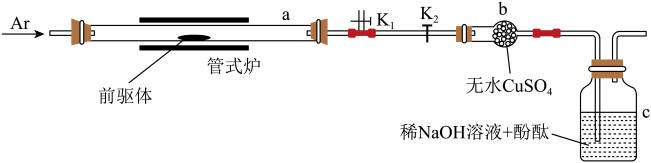
①加热前,打开关闭 , 先通入Ar气一段时间;开始加热后,再打开关闭 , 继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有。
②前驱体受热分解过程中:a中气体略有红棕色,说明产物含有;b中试剂变蓝,说明产物含有;c中溶液颜色变化的过程为。
(5)、前驱体不含结晶水,其摩尔质量是587g/mol,阴离子与阳离子(仅有)的个数比为2.75,则由前驱体生成的化学反应方程式为。17. 氨具有较高的含氢量,可用作内燃机的燃料。(1)、液氨是重要的非水溶剂,和水类似,液氨的电离平衡为。写出与在液氨中发生中和反应的化学方程式为。(2)、合成氨反应的方程式为: , 恒压密闭容器中,起始时 , 不同温度(T)下平衡混合物中物质的量分数随压强的变化曲线如图所示。
①25℃时,和的燃烧热分别为akJ/mol和bkJ/mol,上述合成氨反应的焓变为kJ/mol。
②A点的温度迅速从变为 , 则此时浓度商QK()(填“>”“<”或“=”)。
③(为以分压表示的平衡常数,分压=总压×物质的量分数)。
④合成氨逆反应速率方程为: , 式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为。
(3)、合成氨也可以通过电化学过程实现,其装置如图所示。
①导线中电子流动方向为。
②生成的电极反应式为。
③若惰性电极2的电流效率η为75%,则惰性电极2处与的物质的量之比为。()
18. 固化剂对电子封装材料环氧树脂的性能具有重要影响。某固化剂K的合成路线及相关的反应方程式如下所示(部分试剂及反应条件略)。
制备J的反应方程式:

已知以下信息:
①

②
 (1)、A的结构简式为。(2)、B的链节中官能团名称为。(3)、E与在催化作用下生成
(1)、A的结构简式为。(2)、B的链节中官能团名称为。(3)、E与在催化作用下生成 的反应类型为;F与新制的反应的化学方程式为;试剂G的化学式为。 (4)、C的某同系物分子式为 , 该同系物的同分异构体中L能同时满足以下条件:
的反应类型为;F与新制的反应的化学方程式为;试剂G的化学式为。 (4)、C的某同系物分子式为 , 该同系物的同分异构体中L能同时满足以下条件:(ⅰ)含有苯环 (ⅱ)含有 (ⅲ)不含-O-O-键
且核磁共振氢谱有四组峰(峰面积之比为1:2:2:3),则L的结构简式为(只写一个)。
(5)、一定条件下,B(聚合度n=7)和C按物质的量之比2:1投料完全反应生成D的化学方程式为;生成固化剂K的反应类型为加成反应,则K的结构简式为。