河南省安阳市2023届高三下学期二模理综化学试题
试卷更新日期:2023-04-25 类型:高考模拟
一、单选题
-
1. 化学让生活更美好。下列选项中围绕科技新闻的相关阐述错误的是
选项
科技新闻
相关阐述
A
以芝麻壳为原料,制备高性能超级电容器
芝麻壳的主要成分是油脂
B
通过光热效应,将香蕉皮分解为多孔碳和氢气
天然生物质转化为新能源,实现废物利用
C
C60在一定条件下能转化为导电、高硬度的非晶态碳玻璃
碳玻璃与C60互为同素异形体
D
用紫外线作能源、氯化铝作催化剂,将废弃聚苯乙烯塑料转化为更有价值的产品
聚苯乙烯的链节为
 A、A B、B C、C D、D2. 设NA为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,生成2.24LO2转移的电子数为0.4NA B、2L1mol·L-1的氯化铜溶液中H+数目为4NA C、常温下,5.6g铁与足量稀硝酸反应转移的电子数为0.3NA D、2LpH=5的0.05mol·L-1K2Cr2O7溶液中数目为0.1NA3. 下列根据实验操作及现象所得出的结论正确的是
A、A B、B C、C D、D2. 设NA为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,生成2.24LO2转移的电子数为0.4NA B、2L1mol·L-1的氯化铜溶液中H+数目为4NA C、常温下,5.6g铁与足量稀硝酸反应转移的电子数为0.3NA D、2LpH=5的0.05mol·L-1K2Cr2O7溶液中数目为0.1NA3. 下列根据实验操作及现象所得出的结论正确的是选项
实验操作及现象
结论
A
淀粉溶液和稀硫酸混合加热后,再加新制的Cu(OH)2悬浊液加热,无砖红色沉淀产生
淀粉未水解
B
室温下,向盛有1mL0.2mol·L-1NaOH溶液的试管中滴加2滴0.1mol·L-1MgCl2溶液,产生白色沉淀,再滴加2滴0.1mol·L-1FeCl3溶液,又产生红褐色沉淀
室温下,Fe(OH)3的溶解度小于Mg(OH)2
C
向两支试管中分别加入2mL和1mL0.1mol·L-1Na2S2O3溶液,再向盛有1mLNa2S2O3溶液的试管中加入1mL蒸馏水,最后同时向两支试管中加2mL0.1mol·L-1H2SO4溶液,振荡,加入2mLNa2S2O3溶液的试管先出现浑浊
其他条件一定时,反应物浓度越大,反应速率越快
D
将SO2通入酸性KMnO4溶液中,取反应后的溶液于试管中,再向试管中加入BaCl2溶液,振荡,产生白色沉淀
该环境中SO2的氧化产物为
A、A B、B C、C D、D4. 有机物M是合成塑身药物利莫那班的重要中间体,其结构简式如图所示:
下列关于M的叙述正确的是
A、M的分子式为C15H18O4Cl B、M能使Br2的CCl4溶液褪色 C、M在碱性条件下能稳定存在 D、M苯环上的二溴代物有4种5. 据文献报道,利用阴极膜过滤反应器能除去废水中的磷元素(假设磷元素的存在形态只有),其装置原理示意图如图所示[图中CaP的组成为3Ca3(PO4)2·CaHPO4·zH2O]:下列叙述正确的是 A、三电极流出(入)的电子数均相等 B、工作时Ti/SnO2-Sb电极应与直流电源的负极相连 C、Ti/SnO2-Sb电极周围H2O分子被氧化,其氧化产物为H+和O2 D、阴极区的总反应式:20Ca2++14+26e-+2zH2O=2[3Ca3(PO4)2·CaHPO4·zH2O]↓+13H2↑6. W、X、Y、Z为原子序数依次增大的短周期元素,原子序数之和为32;M是由这四种元素组成的化合物,其化学式为YZX2W2(其中每种元素只有一种化合价);将8.0gM投入水中有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝,向所得溶液中通入足量的CO2 , 经过滤等一系列操作后得到7.8g的白色固体。下列叙述错误的是A、四种元素中有两种金属元素 B、原子半径:Y>Z>X C、M与盐酸反应能生成三种离子化合物 D、Y元素最高价氧化物的水化物能溶解Z元素最高价氧化物7. NaH2PO4、Na2HPO4是新型冠状病毒灭活疫苗的辅料之一。298K时,向H3PO4溶液中逐滴加入NaOH溶液至过量,所得溶液中H3PO4、、、的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=]。下列叙述正确的是(已知:lg2=0.3)
A、三电极流出(入)的电子数均相等 B、工作时Ti/SnO2-Sb电极应与直流电源的负极相连 C、Ti/SnO2-Sb电极周围H2O分子被氧化,其氧化产物为H+和O2 D、阴极区的总反应式:20Ca2++14+26e-+2zH2O=2[3Ca3(PO4)2·CaHPO4·zH2O]↓+13H2↑6. W、X、Y、Z为原子序数依次增大的短周期元素,原子序数之和为32;M是由这四种元素组成的化合物,其化学式为YZX2W2(其中每种元素只有一种化合价);将8.0gM投入水中有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝,向所得溶液中通入足量的CO2 , 经过滤等一系列操作后得到7.8g的白色固体。下列叙述错误的是A、四种元素中有两种金属元素 B、原子半径:Y>Z>X C、M与盐酸反应能生成三种离子化合物 D、Y元素最高价氧化物的水化物能溶解Z元素最高价氧化物7. NaH2PO4、Na2HPO4是新型冠状病毒灭活疫苗的辅料之一。298K时,向H3PO4溶液中逐滴加入NaOH溶液至过量,所得溶液中H3PO4、、、的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=]。下列叙述正确的是(已知:lg2=0.3) A、使δ()增加的离子方程式:H3PO4+2OH-=+2H2O B、b点溶液中:c(Na+)<3c()+3c() C、c点溶液中由水电离出的c(H+)为10-12.7 D、若NaH2PO4和Na2HPO4组成的混合溶液pH=6,则溶液中:c()=400c(H3PO4)
A、使δ()增加的离子方程式:H3PO4+2OH-=+2H2O B、b点溶液中:c(Na+)<3c()+3c() C、c点溶液中由水电离出的c(H+)为10-12.7 D、若NaH2PO4和Na2HPO4组成的混合溶液pH=6,则溶液中:c()=400c(H3PO4)二、实验题
-
8. [Co(NH3)6]Cl3(三氯化六氨合钴)属于经典配合物,实验室以Co为原料制备[Co(NH3)6]Cl3的方法和过程如下:
I.制备CoCl2
已知:钴单质与氯气在加热条件下反应可制得纯净CoCl2 , 钴单质在300℃以上易被氧气氧化;CoCl2熔点为86℃,易潮解。制备装置如下:
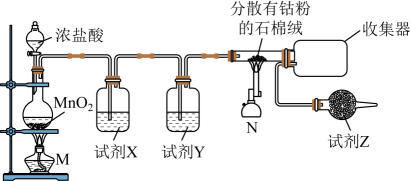 (1)、制氯气的反应中,还原剂与氧化剂物质的量之比为。(2)、试剂X通常是(填名称)。(3)、试剂Z的作用为。(4)、为了获得更纯净的CoCl2 , 开始点燃N处酒精喷灯的标志是。(5)、Ⅱ.制备[Co(NH3)6]Cl3——配合、氧化
(1)、制氯气的反应中,还原剂与氧化剂物质的量之比为。(2)、试剂X通常是(填名称)。(3)、试剂Z的作用为。(4)、为了获得更纯净的CoCl2 , 开始点燃N处酒精喷灯的标志是。(5)、Ⅱ.制备[Co(NH3)6]Cl3——配合、氧化已知:①Co2+不易被氧化;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3在水中的溶解度曲线如图所示:

③加入少量浓盐酸有利于[Co(NH3)6]Cl3析出。
按图组装好装置→(填序号,下同)→打开磁力搅拌器→控制温度在10℃以下→→加热至60℃左右,恒温20min→在冰水中冷却所得混合物,即有晶体析出(粗产品)。

①缓慢加入H2O2溶液
②滴加稍过量的浓氨水
③向三颈烧瓶中加入活性炭、CoCl2、NH4Cl和适量水
(6)、写出氧化阶段发生反应的离子方程式:。(7)、粗产品可用重结晶法提纯:向粗产品中加入80℃左右的热水,充分搅拌后, , 冷却后向滤液中加入少量 , 边加边搅拌,充分静置后过滤,用无水乙醇洗涤晶体2~3次,低温干燥,得纯产品[Co(NH3)6]Cl3。三、非选择题
-
9. 氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种以含锌烟灰(含有ZnO、CuO、PbO、FeO、Fe2O3、MnO、MnO2、CdO等)为原料制备氧化锌的工艺流程如图所示:

已知:i.二价金属氧化物能分别与氨配合生成配离子,如[Fe(NH3)2]2+、[Mn(NH3)2]2+、[Zn(NH3)4]2+;
ii.25℃时相关物质的Ksp如下表:
物质
MnS
FeS
ZnS
PbS
CdS
CuS
Ksp
2.5×10-13
6.3×10-18
1.6×10-24
8.0×10-28
3.6×10-29
5.0×10-36
iii.Zn(OH)2和ZnCO3的分解温度分别为125℃、300℃。
请回答下列问题:
(1)、“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2 , 写出生成FeOOH的离子方程式:;“氧化预处理”的目的是。(2)、若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O):n(NH4HCO3)=2:1,写出该反应的离子方程式:。(3)、已知:4NH3(aq)+Cu2+(aq)=[Cu(NH3)4]2+(aq) K=1013 , 则[Cu(NH3)4]2+(aq)+S2-(aq)=CuS(s)+4NH3(aq)的化学平衡常数K1为。(4)、实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。
①用水蒸气对装置b加热时,连接装置a、b的导管应插入装置b的位置为(填字母)。
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是(写出一种)。
③混合气体e可返回至“”阶段循环利用。
(5)、研究发现Znx(OH)y(CO3)z。热分解得到ZnO的过程可分为两步。某实验小组取11.2gZnx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率()依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为。10. CO2与CH4均是温室气体,CO2与CH4催化重整受到越来越多的关注,它是有效应对全球气候变化的重要方法。(1)、CO2与CH4经催化重整可制得合成气CO和H2 , 其反应原理为CO2(g)+CH4(g)2CO(g)+2H2(g) ΔH=+120kJ·mol-1①该反应在一定温度下能自发进行的原因为。
②已知键能是指气态分子中1mol化学键解离成气态原子所吸收的能量,上述反应中相关的化学键键能数据如下:
化学键
C-H
C≡O
H-H
键能/(kJ·mol-1)
413
1075
436
则CO2(g)=C(g)+2O(g) ΔH=kJ·mol-1。
(2)、 催化重整涉及的反应如下:i.CH4(g)+CO2(g)2H2(g)+2CO(g)
ii.H2(g)+CO2(g)H2O(g)+CO(g) ΔH=+41.2kJ·mol-1
若在恒温、恒容密闭容器中进行反应i、ii,下列事实能说明上述反应达到平衡状态的是____ (填字母)。
A、相同时间内形成C-H键和H-H键的数目之比为2:1 B、体系内n(H2)/n(CO)保持不变 C、体系内各物质的浓度保持不变 D、体系内混合气体的密度保持不变(3)、在总压为24p0的恒压密闭容器中,起始时通入n(CH4):n(CO2)=1:1的混合气体,在一定温度下发生反应i、ii,测得CH4、CO2的平衡转化率分别为20%和40%。①平衡时容器的体积是起始时的倍。
②该温度下反应i的压强平衡常数Kp=(Kp为用分压表示的平衡常数,分压=总压×物质的量分数)。
③维持其他因素不变,若向平衡体系中通入一定量的N2(N2不参与反应),再次平衡后CH4的转化率 (填“增大”“减小”“不变”或“无法判断”,下同),。
(4)、光催化甲烷重整技术也是研究热点。以Rh/SrTiO3为光催化剂,光照时,价带失去电子并产生空穴(h+ , 具有强氧化性),CO2在导带获得电子生成CO和O2- , 价带上CH4直接转化为CO和H2 , 反应机理如图所示:
在Rh表面,每生成1molCO,则价带产生的空穴(h+)数为NA;价带上的电极反应式可表示为。
11. 利用石灰石可吸收烟气中的H2S,其相关反应如下:反应i:CaCO3(s)CaO(s)+CO2(g)
反应ii:CaO(s)+H2S(g)CaS(s)+H2O(g)
反应iii:CaS(s)+2O2(g)CaSO4(s)
请回答下列问题:
(1)、基态硫原子价电子排布式为 , 其核外电子有种空间运动状态。(2)、钙元素的焰色反应呈砖红色,焰色属于(填“吸收”或“发射”)光谱;元素S、Ca、O中,第一电离能最大的是(填元素符号)。(3)、H2S和PH3分子的价层电子对数为 , PH3分子中的H-P-H键角大于H2S中的H-S-H键角,请从价层电子互斥理论解释其原因是。(4)、晶体CaCO3中含有的化学键有(填字母)。a.σ键b.π键c.离子键d.非极性键
(5)、CaCO3、MgCO3热分解温度更高的是原因是。(6)、方解石的成分为CaCO3 , 其晶胞结构如图所示,晶胞参数:高为cnm,晶胞底面为平行四边形,边长为anm。若用NA表示阿伏加德罗常数的值,则该方解石的密度为g·cm-3(用含a、c、NA的代数式表示)。 12. 溴丙胺太林是一种辅助治疗十二指肠溃疡的药物,其合成路线如图所示:
12. 溴丙胺太林是一种辅助治疗十二指肠溃疡的药物,其合成路线如图所示:
请回答下列问题:
(1)、B的化学名称为;H中含有的官能团名称为。(2)、F转化为G的反应类型是。(3)、写出I转化为K的化学方程式:。(4)、X是I的同分异构体,具有如下结构与性质:①含有
 结构;②能发生银镜反应;③除苯环外,不含其他环符合条件的X共有种,其中核磁共振氢谱有3组峰,且峰面积比为1:2:2的结构简式为。(5)、写出仅以乙烯为有机原料通过四步反应制备丁二酸的合成路线:(无机试剂任选)。
结构;②能发生银镜反应;③除苯环外,不含其他环符合条件的X共有种,其中核磁共振氢谱有3组峰,且峰面积比为1:2:2的结构简式为。(5)、写出仅以乙烯为有机原料通过四步反应制备丁二酸的合成路线:(无机试剂任选)。
-