北京市顺义区2023届高三下学期第二次化学统练题
试卷更新日期:2023-04-25 类型:高考模拟
一、单选题
-
1. “齐天圣鼓”又称“猴鼓”,起源于唐朝,堪称中原一绝,是中国非物质文化遗产之一。猴鼓的结构如图所示。下列说法错误的是
 A、牛皮面的主要成分是蛋白质,耐高温 B、竹钉的主要成分是纤维素,属于天然高分子 C、桐油是从桐籽中提炼出来的油脂,属于酯类 D、铜质鼓环不宜采用铁质铆钉固定2. 下列化学用语使用正确的是A、H2O的VSEPR模型:
A、牛皮面的主要成分是蛋白质,耐高温 B、竹钉的主要成分是纤维素,属于天然高分子 C、桐油是从桐籽中提炼出来的油脂,属于酯类 D、铜质鼓环不宜采用铁质铆钉固定2. 下列化学用语使用正确的是A、H2O的VSEPR模型: B、次氯酸的电子式:
B、次氯酸的电子式: C、中子数为20的硫原子:S
D、乙醛的结构简式:CH3COH
3. 氨硼烷(BH3NH3)分子结构和乙烷相似,是一种固体储氢材料。下列关于氨硼烷的说法错误的是A、N和B元素均位于元素周期表的p区 B、第一电离能:N<B C、分子中N原子与B原子间形成了配位键 D、氨硼烷固态时为分子晶体4. 下列方程式与所描事实不相符的是A、硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2+4H+=2I2+2H2O B、SO2通入溴水中,溴水褪色:SO2+Br2+2H2O=2HBr+H2SO4 C、CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s) D、工人将模具干燥后再注入熔融钢水,防止反应:2Fe+H2OFe2O3+3H25. 黑木耳中富含铁元素,欲测定黑木耳中铁元素含量,按如下流程进行实验,对应操作正确的是
C、中子数为20的硫原子:S
D、乙醛的结构简式:CH3COH
3. 氨硼烷(BH3NH3)分子结构和乙烷相似,是一种固体储氢材料。下列关于氨硼烷的说法错误的是A、N和B元素均位于元素周期表的p区 B、第一电离能:N<B C、分子中N原子与B原子间形成了配位键 D、氨硼烷固态时为分子晶体4. 下列方程式与所描事实不相符的是A、硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2+4H+=2I2+2H2O B、SO2通入溴水中,溴水褪色:SO2+Br2+2H2O=2HBr+H2SO4 C、CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s) D、工人将模具干燥后再注入熔融钢水,防止反应:2Fe+H2OFe2O3+3H25. 黑木耳中富含铁元素,欲测定黑木耳中铁元素含量,按如下流程进行实验,对应操作正确的是
A
B
C
D




称量
灼烧
酸溶
过滤
A、A B、B C、C D、D6. 氮氧化物是大气污染物之一,如图为科研人员探究消除氮氧化物的反应机理,下列说法错误的是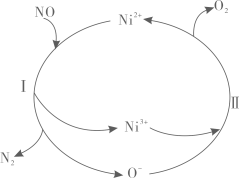 A、过程I中NO既作氧化剂又作还原剂 B、过程II中每生成1molO2时,转移电子的数目约为4×6.02×1023 C、过程中涉及的反应均为氧化还原反应 D、整个过程中Ni2+作催化剂7. S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法错误的是
A、过程I中NO既作氧化剂又作还原剂 B、过程II中每生成1molO2时,转移电子的数目约为4×6.02×1023 C、过程中涉及的反应均为氧化还原反应 D、整个过程中Ni2+作催化剂7. S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法错误的是 A、结构式为Cl-S-S-Cl B、是含有极性键的非极性分子 C、与S2Br2结构相似,熔、沸点:S2Br2>S2Cl2 D、与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl8. 短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最多的元素,W的单质常温下是黄绿色气体。由这四种元素组成的化合物A是一种重要的脱氢剂,化合物A与氢气反应可以生成化合物B,其过程如图所示。下列说法错误的是
A、结构式为Cl-S-S-Cl B、是含有极性键的非极性分子 C、与S2Br2结构相似,熔、沸点:S2Br2>S2Cl2 D、与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl8. 短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最多的元素,W的单质常温下是黄绿色气体。由这四种元素组成的化合物A是一种重要的脱氢剂,化合物A与氢气反应可以生成化合物B,其过程如图所示。下列说法错误的是 A、工业上可采用电解饱和食盐水的方法制备W的单质 B、Y的最高价氧化物的水化物是强电解质 C、Y、Z与氢三种元素形成化合物的晶体类型一定是分子晶体 D、用FeCl3溶液可鉴别A和B9. 氯化亚铜(CuCl)是白色粉末,微溶于水,广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2•2H2O制备CuCl的过程,并进行相关物质转化的探究。
A、工业上可采用电解饱和食盐水的方法制备W的单质 B、Y的最高价氧化物的水化物是强电解质 C、Y、Z与氢三种元素形成化合物的晶体类型一定是分子晶体 D、用FeCl3溶液可鉴别A和B9. 氯化亚铜(CuCl)是白色粉末,微溶于水,广泛应用于化工和印染等行业。某研究性学习小组模拟热分解CuCl2•2H2O制备CuCl的过程,并进行相关物质转化的探究。已知:酸性条件下Cu+不稳定
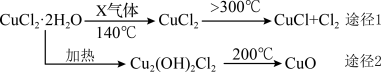
下列说法错误的是
A、X气体是HCl,可抑制CuCl2•2H2O加热时水解 B、途径1中产生的Cl2可以回收利用,也可以通入饱和NaOH溶液中除去 C、途径2中200℃时反应的化学方程式为Cu2(OH)2Cl22CuO+2HCl↑ D、CuCl与稀硫酸反应的离子方程式为2Cu++4H++SO=2Cu2++SO2↑+2H2O10. 某同学设计下述实验检验[Ag(NH3)2]Cl溶液中的Ag+ , 实验如表:实验
试剂
现象
试管
滴管

2mL[Ag(NH3)2]Cl溶液
6滴0.1 mol∙L−1KCl溶液
I中无明显现象
6滴0.1 mol∙L−1KI溶液
II中产生黄色沉淀
6滴0.1 mol∙L−1HCl溶液
III中产生白色沉淀
6滴饱和KCl溶液
IV中产生白色沉淀
下列说法错误的是
A、I中的c(Ag+)较小,不足以与Cl-沉淀 B、II中存在平衡:AgI(s)Ag+(aq)+I-(aq) C、III说明NH3与H+的结合能力小于与Ag+的结合能力 D、配离子与其它离子能否反应,其本质是平衡移动的问题11. 羟甲香豆素(丙)是一种治疗胆结石的药物,部分合成路线如图所示,下列说法错误的是 A、甲中的官能团为羟基、酯基 B、1mol乙最多消耗4molNaOH C、丙能使酸性高锰酸钾溶液褪色 D、上述转化涉及的反应类型有取代反应、消去反应12. 下列实验过程能达到实验目的的是
A、甲中的官能团为羟基、酯基 B、1mol乙最多消耗4molNaOH C、丙能使酸性高锰酸钾溶液褪色 D、上述转化涉及的反应类型有取代反应、消去反应12. 下列实验过程能达到实验目的的是选项
实验目的
实验过程
A
检验某铁的氧化物含二价铁
将该氧化物溶于浓盐酸,滴入KMnO4溶液,紫色褪去
B
检验乙醇中含有水
向乙醇中加入一小粒金属钠,产生无色气体
C
证明酸性:H2SO3>HClO
在Ca(ClO)2溶液中通入SO2 , 产生白色沉淀
D
证明:CO2有氧化性
将点燃的镁条,迅速伸入盛满CO2的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生
A、A B、B C、C D、D13. 高电压水系锌-有机混合液流电池的装置如图所示。下列说法错误的是 A、放电时,负极反应式为:Zn-2e-+4OH-=Zn(OH) B、放电时,正极反应式为:FQ+2H++2e-=FQH2 C、充电时,1molFQH2转化为FQ转移2mol电子 D、充电时,中性电解质NaCl溶液的浓度增大14. 工业上可用“氨催化氧化法”生产NO,以氨气、氧气为原料,在Pt-Rh合金催化剂存在下生成NO和副产物N2 , 两个竞争反应化学方程式如下:
A、放电时,负极反应式为:Zn-2e-+4OH-=Zn(OH) B、放电时,正极反应式为:FQ+2H++2e-=FQH2 C、充电时,1molFQH2转化为FQ转移2mol电子 D、充电时,中性电解质NaCl溶液的浓度增大14. 工业上可用“氨催化氧化法”生产NO,以氨气、氧气为原料,在Pt-Rh合金催化剂存在下生成NO和副产物N2 , 两个竞争反应化学方程式如下:Ⅰ.4NH3(g)+5O2(g)4NO(g)+6H2O(g)
Ⅱ.4NH3(g)+3O2(g)2N2(g)+6H2O(g)
现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示:

已知:有效转化率=×100%
下列说法错误的是
A、400℃时,主要发生反应Ⅱ B、由图分析工业上用氨催化氧化制备HNO3 , 最佳温度约为840℃ C、520℃时,NH3的有效转化率约为66.7% D、840℃后,NO的物质的量下降,可能是反应I平衡逆向移动所致二、非选择题
-
15. 铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅶ族的元素,其化合物在生产生活中应用广泛。(1)、基态Fe的价层电子排布式为。(2)、以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。

①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为。
②色胺酮分子中N原子的杂化类型为。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过作用与色胺酮钴配合物相结合。
(3)、超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:
①距离Mg原子最近的Ni原子有个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA , 该晶体的密度为g•cm-3。(1nm=10-9m)
16. 次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。(1)、NaH2PO2中P的化合价为。(2)、将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍的目的,该过程中H2PO被氧化为二元弱酸H3PO3 , 写出该反应的离子方程式。(3)、次磷酸钠的制备将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:
①装置A中盛放烧碱溶液的仪器名称为。
②装置B的作用为。
③装置C中发生反应的化学方程式为。
④已知相关物质的溶解度如表:
溶解度/g物质
25℃
100℃
NaCl
37
39
NaH2PO2
100
667
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后(填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
(4)、产品纯度的计算取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL0.100mol•L-1碘水,充分反应。然后以淀粉溶液作指示剂,用0.100mol•L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液24.00mL,有关反应的方程式为:H2PO+H2O+I2=H2PO+2H++2I— , 2S2O+I2=S4O+2I- , 则产品纯度为(NaH2PO2式量88)。
17. 药物M可用于治疗动脉硬化,其合成路线如图。
已知:
i.B的核磁共振氢谱只有1个峰;
ii.
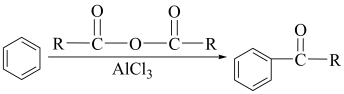 (1)、M的官能团为。(2)、A的名称为。(3)、C与B含氧官能团相同,C可能的结构简式为(任写一种)。(4)、反应④的反应类型是。(5)、反应⑤的化学方程式为。(6)、G的同分异构体有多种,写出同时满足下列条件的同分异构体的结构简式。
(1)、M的官能团为。(2)、A的名称为。(3)、C与B含氧官能团相同,C可能的结构简式为(任写一种)。(4)、反应④的反应类型是。(5)、反应⑤的化学方程式为。(6)、G的同分异构体有多种,写出同时满足下列条件的同分异构体的结构简式。①不存在顺反异构 ②结构中含有酚羟基 ③苯环上有两个取代基且位于间位
(7)、已知: →
→ +H2O,以G为起始原料,选择必要的无机试剂合成I,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 18. 以废旧铜电路板为原料制备硫酸铜晶体可变废为宝,如图是某工厂的实际制备工艺流程。
+H2O,以G为起始原料,选择必要的无机试剂合成I,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 18. 以废旧铜电路板为原料制备硫酸铜晶体可变废为宝,如图是某工厂的实际制备工艺流程。
资料1:流程中RH为有机化合物
(1)、浸取前将废旧铜电路板粉碎的目的是。(2)、上述流程中需要用到分液操作步骤是(填序号)。(3)、浸取后得到的溶液铜元素主要以[Cu(NH3)4]2+形式存在,浸取时发生反应的离子方程式为。(4)、研究发现,加入H2O2后随温度升高,铜元素浸出率随温度变化的曲线如图。分析温度高于85℃,铜元素浸出率下降可能的原因。 (5)、工艺流程中循环使用的物质有:NH3、、有机溶剂、。(6)、该工厂排放的水质情况及国家允许的污水排放标准如表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如图所示。
(5)、工艺流程中循环使用的物质有:NH3、、有机溶剂、。(6)、该工厂排放的水质情况及国家允许的污水排放标准如表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如图所示。
项目
废水水质
排放标准
pH
1.0
6~9
Cu2+含量/(mg•L-1)
72
≤0.5
NH含量/(mg•L-1)
2632
≤15
资料2:Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-
①根据实验结果分析,处理废水中Cu2+的最佳pH约为。
②结合资料解释实验结果图中b到d段曲线所示的过程。
19. 某化学小组探究乙醛银镜反应后试管上银的去除方案。已知:实验条件空气的影响忽略不计。
(1)、写出乙醛发生银镜反应的化学方程式。(2)、向附有银镜的试管中加入稀HNO3 , 试管壁上的银逐渐消失,管口有浅红棕色气体生成,产生浅红棕色气体的化学方程式是。(3)、小组同学认为使用稀硝酸易产生污染性气体,考虑到铁盐也有较强的氧化性,用铁盐去除银镜对环境有利,于是进行如表实验:序号
实验操作
现象
I
向附有少量银镜的试管中,加入5mL0.1mol•L-1Fe(NO3)3溶液(过量,pH=2),振荡试管
银镜慢慢消失,溶液澄清
对银镜的消失原因小组同学作出如下假设:
假设1:Fe3+具有氧化性,能氧化Ag;
假设2:……。
回答下列问题:
①补全假设2:。
②甲同学通过设计实验,证明了假设2成立,他设计的方案为:向附有少量银镜的试管中,加入 , 充分振荡,银镜消失。
③为证明假设1,乙同学用同浓度FeCl3溶液替换Fe(NO3)3溶液,进行下列实验:
序号
实验操作
现象
II
向附有少量银镜的试管中,加入5mL0.1mol•L-1FeCl3溶液(过量,pH=2),振荡试管
银镜快速溶解,反应后溶液中有明显灰色沉淀
丙同学查阅文献得知:Fe3+氧化性与Ag+接近,实验II中银镜能快速溶解,可能与生成氯化银沉淀有关,用平衡移动原理解释原因。
④为证明自己的观点,丙同学的通过积极思考,设计了实验III。
实验III:如图连接装置进行实验,电压表的指针向左偏转,记录电压示数为a。

已知:电压大小反映了物质氧化性与还原性强弱的差异;物质氧化性与还原性强弱的差异越大,电压越大。
将U形管右侧溶液替换成0.1mol•L-1NaNO3溶液,重做上述实验,电流表指针向左偏转,记录电压示数为b,能证明丙同学观点的实验证据是。
(4)、总结上述实验,小组同学认为HBr溶液和HI溶液也能去除试管上的银镜,并进行如表实验。序号
实验操作
现象
IV
向附有少量银镜的试管中,加入5mL1mol•L-1的HBr溶液,不断振荡。
银镜不溶解
V
向附有少量银镜的试管中,加入5mL1mol•L-1的HI溶液,不断振荡。
银镜溶解,有黄色沉淀产生,且有气泡产生
已知:常温下Ksp(AgBr)=5.4×10-13;Ksp(AgI)=8.5×10-17 , 分析相同条件下银镜能溶于5mL1mol•L-1的HI溶液,而不溶于HBr溶液的原因。