广东省珠海市2021-2022学年高一下学期期末考试化学试题
试卷更新日期:2023-04-17 类型:期末考试
一、单选题
-
1. 资源、能源、材料、环保、健康、安全等是当今社会重要的研究课题,下列说法错误的是A、在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响 B、施用化肥和农药是保障农作物增产、减少农作物损失的重要措施 C、处方药需要凭医生处方才能从药房或药店获得,并要在医生的指导下使用。 D、当前,新能源使用量已超过化石能源,成为人类使用的主要能源2. 下列过程属于物理变化的是A、石油裂化 B、煤的干馏 C、海水晒盐 D、海水提溴3. 人体的营养物质包括糖类、油脂、蛋白质、维生素、无机盐和水,下列关于某些营养物质的说法错误的是A、医用酒精能使鸡蛋清从其水溶液中析出而又不改变它的化学性质 B、油脂都可以看作是脂肪酸与甘油通过酯化反应形成的酯 C、糖类是绿色植物光合作用的产物,也是人类最重要的能量来源 D、人类体内没有水解纤维素的酶,无法吸收和利用纤维素,但食物中的纤维素有助于消化和排泄。4. 下列关于SO2的叙述正确的是A、SO2是无色、无味、有毒的气体 B、SO2不能使酸性高锰酸钾褪色 C、SO2的大量排放是形成酸雨的唯一原因 D、SO2与NaOH溶液反应可能生成Na2SO3或NaHSO35. 据报道,我国华为公司的技术标准成为世界“5G”通讯标准的重要组成部分。随着“5G”时代的逐渐到来,以光导纤维为基础的信息高速通道更显重要。制造光导纤维的材料是( )A、晶体硅 B、二氧化硅 C、铜合金 D、不锈钢6. 下列气体中,既可用浓硫酸干燥,又可用NaOH固体干燥的是A、Cl2 B、NH3 C、O2 D、HCl7. 对于反应:2A(g)+B(g)2C(g),保持其他条件不变,只改变下列一个反应条件,不能使生成C的反应速率加快的是A、增大反应物的浓度 B、增大压强 C、升高温度 D、扩大容器体积8. 下列关于物质工业制备原理错误的是A、工业制备金属钠:2NaCl2Na+Cl2↑ B、工业生产铁:Fe2O3+3CO2Fe+3CO2 C、湿法炼铜:Fe+CuSO4=Cu+FeSO4 D、工业生产镁:MgCl2+FeFeCl2+Mg9. 将适量蔗糖放入烧杯中,滴几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生气体,下列说法错误的是A、浓硫酸表现出脱水性和强氧化性 B、黑色物质是炭 C、浓硫酸被氧化 D、气体中含有SO2和CO210. 某有机物的结构简式为HO-CH2CH=CHCH3 , 关于该有机物可能发生的反应,下列说法错误的是A、能与Na发生置换反应 B、能与酸性高锰酸钾溶液发生氧化反应 C、能与溴水发生加成反应 D、能与NaHCO3溶液发生复分解反应11. 下列叙述错误的是A、NH3易液化,液氨常用作制冷剂 B、HNO3具有强氧化性,浓度不同,其与金属反应产物也不同 C、铵盐是农业上常用的化肥,绝大多数铵盐受热易分解 D、NO2是无色、无毒气体,它与水发生的反应不属于氧化还原反应12. 反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是
 A、该反应为放热反应 B、改变反应条件,反应物的转化率一定不变 C、充分反应后,原料的转化率可达100% D、该反应中,断裂反应物化学键吸收的能量大于形成生成物化学键放出的能量13. 下列装置中,能构成原电池的是( )A、
A、该反应为放热反应 B、改变反应条件,反应物的转化率一定不变 C、充分反应后,原料的转化率可达100% D、该反应中,断裂反应物化学键吸收的能量大于形成生成物化学键放出的能量13. 下列装置中,能构成原电池的是( )A、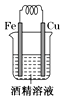 B、
B、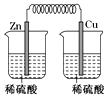 C、
C、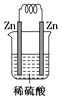 D、
D、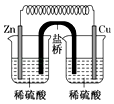 14. 下列说法错误的是A、S、N两元素在自然界均存在单质,且两单质在反应中一定做氧化剂 B、实验室中用NH3或HCl均可以做喷泉实验 C、制作餐具的陶瓷、窗户上的玻璃、建筑用的水泥均为硅酸盐材料 D、银氨溶液和新制的碱性Cu(OH)2悬浊液均能与葡萄糖反应15. “绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是A、Cu+HNO3(浓)→Cu(NO3)2 B、CuCuOCu(NO3)2 C、CuCuCl2Cu(NO3)2 D、CuCuSO4→Cu(NO3)216. 下列实验操作或方案错误的是A、用稀硫酸与锌粒制取时,加几滴溶液以加快反应速率 B、滴入溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液一定含有 C、检验晶体是否已经氧化变质:将样品溶于稀后,滴加溶液,观察溶液是否变红 D、探究催化剂对分解速率的影响:在相同条件下,向一支试管中加入和 , 向另一支试管中加入和溶液,比较实验现象
14. 下列说法错误的是A、S、N两元素在自然界均存在单质,且两单质在反应中一定做氧化剂 B、实验室中用NH3或HCl均可以做喷泉实验 C、制作餐具的陶瓷、窗户上的玻璃、建筑用的水泥均为硅酸盐材料 D、银氨溶液和新制的碱性Cu(OH)2悬浊液均能与葡萄糖反应15. “绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是A、Cu+HNO3(浓)→Cu(NO3)2 B、CuCuOCu(NO3)2 C、CuCuCl2Cu(NO3)2 D、CuCuSO4→Cu(NO3)216. 下列实验操作或方案错误的是A、用稀硫酸与锌粒制取时,加几滴溶液以加快反应速率 B、滴入溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液一定含有 C、检验晶体是否已经氧化变质:将样品溶于稀后,滴加溶液,观察溶液是否变红 D、探究催化剂对分解速率的影响:在相同条件下,向一支试管中加入和 , 向另一支试管中加入和溶液,比较实验现象二、非选择题
-
17. 已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成高分子化合物E和一种具有果香味的物质F,其合成路线如图所示。

回答下列问题:.
(1)、A的结构简式为。(2)、物质B的官能团电子式是。物质C的官能团结构简式为。(3)、反应④的反应类型为。(4)、反应②的化学方程式:。(5)、反应⑤的化学方程式:。反应类型是。(6)、实验室利用如图所示装置制备物质F,试管I中除B、D和浓硫酸外,还要放少量碎瓷片,其作用是 , 试管II中盛放的试剂是溶液。 18.(1)、I.如图是氮气经一系列反应制得硝酸的过程。
18.(1)、I.如图是氮气经一系列反应制得硝酸的过程。请回答:
下列说法正确的是____(选填序号字母)。
A、因断开氮气分子内的共价三键需要较多的能量,所以氮气化学性质很稳定 B、反应②、③、④中氮元素均被氧化 C、分别蘸有浓氨水和浓盐酸的玻璃棒靠近时,会产生白烟(2)、反应①的化学方程式为。(3)、II.实验室制取氨气常采用如图所示装置。
试管中盛放的药品是NH4Cl和Ca(OH)2 , 则试管中的反应方程式为。
(4)、球形干燥管内盛放的药品是碱石灰,其作用是。(5)、棉花润湿的目的是。(6)、图中尾部收集氨气时,从所收集气体的纯度上看,若伸入试管中的导管很短,收集效果会(“更好”,“更差”,“没有区别”)。19. 海带中含有丰富的碘。为了从海带中提取碘,某实验小组设计并进行了以下实验,请填写下列空白: (1)、在实验室中,步骤①须在____(选填实验仪器的标号字母)中进行。A、烧杯 B、坩埚 C、蒸发皿 D、试管 E、烧瓶 F、锥形瓶(2)、步骤③的实验操作名称是 , 需要用到的玻璃仪器有:烧杯、漏斗和。(3)、步骤④所加药品若更换成Cl2 , 则相应的离子方程式为: , 反应中的氧化产物是。(4)、步骤⑤中,选择用苯来提取碘的理由是____。A、苯与水不能互溶 B、碘单质在苯中的溶解度远大于在水中的溶解度 C、苯的密度小于水的密度 D、苯是无色液体(5)、海带灰中含有的可溶性硫酸盐、碳酸盐等,在实验步骤(填序号)中实现与碘分离。(6)、要检验提取碘后的水溶液中是否还有单质碘,需要的试剂是。20.(1)、I.中国积极推进低碳发展,力争在2030年前实现碳达峰,2060年前实现碳中和。
(1)、在实验室中,步骤①须在____(选填实验仪器的标号字母)中进行。A、烧杯 B、坩埚 C、蒸发皿 D、试管 E、烧瓶 F、锥形瓶(2)、步骤③的实验操作名称是 , 需要用到的玻璃仪器有:烧杯、漏斗和。(3)、步骤④所加药品若更换成Cl2 , 则相应的离子方程式为: , 反应中的氧化产物是。(4)、步骤⑤中,选择用苯来提取碘的理由是____。A、苯与水不能互溶 B、碘单质在苯中的溶解度远大于在水中的溶解度 C、苯的密度小于水的密度 D、苯是无色液体(5)、海带灰中含有的可溶性硫酸盐、碳酸盐等,在实验步骤(填序号)中实现与碘分离。(6)、要检验提取碘后的水溶液中是否还有单质碘,需要的试剂是。20.(1)、I.中国积极推进低碳发展,力争在2030年前实现碳达峰,2060年前实现碳中和。已知反应CO(g)+2H2(g)CH3OH(g)中相关的化学键键能数据如表:
化学键
H-H
C-O
C≡O
H-O
C-H
E(kJ·mol-1)
436
343
1076
465
413
①若有1molCH3OH生成,反应需要(填“吸收”或“放出”)kJ能量。
②某温度下,某定容容器中充入1molCO和2molH2发生上述反应,对于该反应,下列说法正确的是。
A.反应过程中n(CO):n(H2)不变
B.若容器内气体密度不变,说明反应达到平衡
C.升高温度,正反应速率减小
D.n(CO):n(H2);n(CH3OH)=1:2:1说明反应已达平衡
(2)、工业上还常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:反应I.CO2(g)+3H2(g)CH3OH(g)+H2O(g)
反应II.CO2(g)+H2(g)CO(g)+H2O(g)
温度为T℃时,在一个刚性容器中模拟工业上合成CH3OH,往容器中通入1molCO2、3molH2进行反应,反应过程中容器内的压强随着时间变化如表所示。
时间/min
0
10
20
30
40
50
压强/MPa
120
105
95
90
88
88
请计算反应开始至40min时,CH3OH的平均反应速率MPa/min;平衡时n(CH3OH)是n(CO)的4倍,则H2的平衡分压是MPa。(分压=总压×气体物质的量分数)
(3)、II.乙醇燃料电池可以作为笔记本电脑、汽车等的能量来源,其工作原理如图所示。请回答下列问题:
请写出电极a上的电极反应式。
(4)、放电过程中1mol乙醇参与反应,理论上需要消耗标况下的O2的体积为。