广东省茂名市电白区2021-2022学年高一下学期期末(选择性)考试化学试题
试卷更新日期:2023-04-17 类型:期末考试
一、单选题
-
1. 新中国成立70年以来,高分子材料以独特的结构和性能在科学技术、国防建设和国民经济等领域发挥重要作用。下列材料中主要成分不属于有机高分子的是( )




A.宇航服
B.汽车轮胎
C.口罩的聚丙烯熔喷布
D.螺纹钢
A、A B、B C、C D、D2. 我国努力争取2060年实现碳中和.下列做法与碳中和目标实现无关的是( )A、将煤炭粉碎再燃烧 B、利用捕集废气中的 C、研发新型催化剂将分解成碳材料 D、将转化为等,实现资源化利用3. 有机化合物在生产生活中应用广泛。下列说法错误的是( )A、新冠疫苗需要低温储存 B、土豆用作酿酒的原料 C、橡胶老化是由于发生了加成反应 D、氢化植物油可用于生产人造奶油4. 下列化学用语表示错误的是A、羟基的电子式: B、乙烷的球根模型:
B、乙烷的球根模型: C、氯原子的结构示意图:
C、氯原子的结构示意图: D、四氯化碳的电子式:
D、四氯化碳的电子式: 5. 某化学兴趣小组根据反应Fe+Cu2+=Fe2++Cu设计如图所示原电池,下列说法错误的是( )
5. 某化学兴趣小组根据反应Fe+Cu2+=Fe2++Cu设计如图所示原电池,下列说法错误的是( ) A、铁电极发生氧化反应 B、Y可以是氯化铜溶液 C、X可以是铜或石墨 D、电子从铁电极经Y流向X电极6. 有4种碳架结构如下的烃,下列说法错误的是( )
A、铁电极发生氧化反应 B、Y可以是氯化铜溶液 C、X可以是铜或石墨 D、电子从铁电极经Y流向X电极6. 有4种碳架结构如下的烃,下列说法错误的是( ) A、a和d是同分异构体 B、b的碳原子可能共平面 C、a和c是同系物 D、四种物质都能发生取代反应7. 无色溶液中下列离子能够共存的是( )A、、、、 B、、、、 C、、、、 D、、、、8. 下列说法正确的是( )A、 互为同位素 B、一氯甲烷和二氯甲烷互为同分异构体 C、 和 互为同素异形体 D、 和 是同系物9. 下列说法错误的是A、自然界中存在游离态的金属单质 B、金属活动性不同,冶炼方法也有所不同 C、地球上金属矿物资源是取之不尽的,因此,应加大开采金属矿物的速度,以满足经济发展的需要 D、废旧金属的回收利用,有利于环境保护10. 食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是 ( )A、淀粉的含量 B、二氧化硫的含量 C、亚硝酸盐的含量 D、甲醛的含量11. 下列有关说法错误的是( )A、碳原子间能形成单键、双键或三键,多个碳原子也可以构成碳链或碳环 B、分子式为的有机化合物一定为丙烯 C、甲烷的二氯代物只有一种证明甲烷为正四面体结构 D、钠与乙醇反应比水的缓和,说明受乙基影响,醇羟基中H原子活泼性减弱12. 设NA为阿伏加德罗常数,下列说法正确的是( )A、1.6gO2和O3混合气体中,所含氧原子数目为0.1NA B、1mol/LAl2(SO4)3溶液中,所含数目为3NA C、标准状况下,11.2LCCl4中所含氯原子数目为2NA D、71gCl2与足量NaOH溶液反应,转移电子数目为2NA13. 氨甲环酸可用于治疗出血症,其结构简式如下图所示。下列关于氨甲环酸说法错误的是( )
A、a和d是同分异构体 B、b的碳原子可能共平面 C、a和c是同系物 D、四种物质都能发生取代反应7. 无色溶液中下列离子能够共存的是( )A、、、、 B、、、、 C、、、、 D、、、、8. 下列说法正确的是( )A、 互为同位素 B、一氯甲烷和二氯甲烷互为同分异构体 C、 和 互为同素异形体 D、 和 是同系物9. 下列说法错误的是A、自然界中存在游离态的金属单质 B、金属活动性不同,冶炼方法也有所不同 C、地球上金属矿物资源是取之不尽的,因此,应加大开采金属矿物的速度,以满足经济发展的需要 D、废旧金属的回收利用,有利于环境保护10. 食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是 ( )A、淀粉的含量 B、二氧化硫的含量 C、亚硝酸盐的含量 D、甲醛的含量11. 下列有关说法错误的是( )A、碳原子间能形成单键、双键或三键,多个碳原子也可以构成碳链或碳环 B、分子式为的有机化合物一定为丙烯 C、甲烷的二氯代物只有一种证明甲烷为正四面体结构 D、钠与乙醇反应比水的缓和,说明受乙基影响,醇羟基中H原子活泼性减弱12. 设NA为阿伏加德罗常数,下列说法正确的是( )A、1.6gO2和O3混合气体中,所含氧原子数目为0.1NA B、1mol/LAl2(SO4)3溶液中,所含数目为3NA C、标准状况下,11.2LCCl4中所含氯原子数目为2NA D、71gCl2与足量NaOH溶液反应,转移电子数目为2NA13. 氨甲环酸可用于治疗出血症,其结构简式如下图所示。下列关于氨甲环酸说法错误的是( ) A、分子式为 B、含氧官能团为羧基 C、能发生取代反应 D、分子中所有碳原子共平面14. 用乙酸和乙醇反应制备乙酸乙酯的装置如图,下列说法正确的是( )
A、分子式为 B、含氧官能团为羧基 C、能发生取代反应 D、分子中所有碳原子共平面14. 用乙酸和乙醇反应制备乙酸乙酯的装置如图,下列说法正确的是( ) A、试管a中药品添加顺序依次为:浓硫酸、乙醇、乙酸 B、导管伸入试管b中液面以下,防止产物挥发造成损失 C、浓硫酸作反应的催化剂,同时可吸水提高酯的产率 D、试管b中溶液红色变浅,是因与乙醇发生反应15. 一定温度下,在体积为1.5 L的密闭容器内发生反应,气体X、Y物质的量随时间变化如图,下列说法正确的是( )
A、试管a中药品添加顺序依次为:浓硫酸、乙醇、乙酸 B、导管伸入试管b中液面以下,防止产物挥发造成损失 C、浓硫酸作反应的催化剂,同时可吸水提高酯的产率 D、试管b中溶液红色变浅,是因与乙醇发生反应15. 一定温度下,在体积为1.5 L的密闭容器内发生反应,气体X、Y物质的量随时间变化如图,下列说法正确的是( ) A、该反应化学方程式为:3Y=2X B、前2min,Y的反应速率 C、3min时,X、Y反应速率相等,反应达到平衡 D、6min时,X、Y浓度不再改变,反应停止16. 甲醛(HCHO)与在羟基磷灰石(HAP)表面发生反应的能量—历程关系如图。下列说法错误的是
A、该反应化学方程式为:3Y=2X B、前2min,Y的反应速率 C、3min时,X、Y反应速率相等,反应达到平衡 D、6min时,X、Y浓度不再改变,反应停止16. 甲醛(HCHO)与在羟基磷灰石(HAP)表面发生反应的能量—历程关系如图。下列说法错误的是 A、该反应为放热反应 B、反应过程中,甲醛的键断裂 C、中的氧原子全部来自 D、化学方程式为
A、该反应为放热反应 B、反应过程中,甲醛的键断裂 C、中的氧原子全部来自 D、化学方程式为二、非选择题
-
17. 工业上用饱和食盐水吸收尾气和制备无水。同时得到副产物。实验室用如图装置模拟该制备过程(加热和固定装置已省略):

已知:浓硫酸的沸点为338℃。回答下列问题:
(1)、仪器a的名称 , 导气管b的作用。(2)、装置A中发生的化学反应的化学方程式为。(3)、固、固加热制取氨气的发生装置可以选择下图中的(填编号),反应的化学方程式为。 (4)、利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得 , 然后将滤液、过滤、洗涤、干燥可得另一产物。
(4)、利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得 , 然后将滤液、过滤、洗涤、干燥可得另一产物。 (5)、产品中可能混有少量和杂质,混有杂质的原因可能是 , 检验产品中含有的的实验方法:取少量样品于试管中,加入适量水溶解,。
(5)、产品中可能混有少量和杂质,混有杂质的原因可能是 , 检验产品中含有的的实验方法:取少量样品于试管中,加入适量水溶解,。【可选试剂:稀硝酸、溶液、酸性溶液、溶液、溶液、溶液】
18. 一种从海水中提取金属镁和单质溴的主要步骤如下:
回答下列问题:
(1)、试剂1属于氧化物,它是 , 试剂2是(填化学式)。(2)、操作A中常用玻璃棒,其作用是 , 操作B是(填操作名称)。(3)、溴蒸气通入二氧化硫的水溶液中,其离子方程式为。(4)、设计简易实验证明溶液2含:。(5)、向溶液1中通入热空气的目的是;向溶液2中通入氯气的反应中,氧化剂是(填化学式)。(6)、工业上冶炼金属常用镁作还原剂。如高温下,镁置换中U(铀),写出化学方程式:。19. 研究化学反应的快慢和限度,对工农业生产和人们生活有重要的意义。(1)、Ⅰ.某反应过程的能量变化如图所示:
由图中曲线变化可知,该反应为(填“放热”或“吸热”)反应,破坏旧键需要吸收的能量为(填“E1”、“E2”、“E1+E2”或“E2-E1”下同),破坏cmolC的化学键需要吸收的能量为。
(2)、Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入两种气体发生化学反应生成气态物质,反应中各气态物质的物质的量变化如图所示:
该反应的化学方程式为:;
(3)、0-6s内B的化学反应速率为:。(4)、Ⅱ.工业制硫酸的反应之一为: , 在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2 , 在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。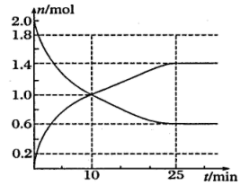
下列叙述不能判断该反应达到平衡状态的是;
①容器中压强不再改变; ②容器中气体密度不再改变;
③O2的物质的量浓度不再改变; ④SO3的质量不再改变;
(5)、根据图示计算达到平衡时SO2的转化率为 ;(6)、Ⅲ.碱性氢氧燃料电池是目前开发的燃料电池之一,这种燃料电池由氢气、空气(氧气)、KOH(电解质溶液)构成。其中正极反应式为下列说法错误的是
①电池放电时通入空气的电极为负极;
②电池放电时,电解质溶液的碱性逐渐减弱;
③电池放电时每消耗3.2gH2转移3.2mol电子。
(7)、写出该燃料电池的负极反应式:。20. 乙烯是重要的有机化工原料,其产量是衡量国家石油化工水平发展的标志。以乙烯和淀粉为原料可以实现下列转化: (1)、的官能团的名称为。(2)、①的反应类型为 , ③的反应类型为。(3)、写出反应③的化学方程式:;写出反应⑥的化学方程式:(4)、上述物质中,能发生银镜反应的物质有、(写名称)。(5)、乙烯与氢气反应得到乙烷,下列物质与乙烷互为同系物的有。
(1)、的官能团的名称为。(2)、①的反应类型为 , ③的反应类型为。(3)、写出反应③的化学方程式:;写出反应⑥的化学方程式:(4)、上述物质中,能发生银镜反应的物质有、(写名称)。(5)、乙烯与氢气反应得到乙烷,下列物质与乙烷互为同系物的有。①
②
③
④

⑤

其中⑤的二氯代物有种。