吉林省“BEST合作体” 2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2023-04-17 类型:期末考试
一、单选题
-
1. 化学与生活、环境密切相关,下列说法正确的是A、丝绸、宣纸及尼龙的主要成分均为合成纤维 B、古代的蜡是高级脂肪酸酯,属于高分子聚合物 C、制作五星红旗用的芳纶为合成纤维 D、废弃的聚乙烯塑料属于白色垃圾,能使溴水褪色2. 下列分子或离子中不能作为配合物的配体的是A、 B、 C、H2O D、NO3. 下列分子或离子的VSEPR模型与空间结构一致的是A、 B、 C、 D、4. 下列物质中,其分子式为的是A、2,3-二甲基丁烷 B、2,3-二甲基-1-戊烯 C、2,4-二甲基戊烷 D、4,5-二甲基-1-己炔5. 分子式为的溴代烃,其分子结构中有一个碳原子不与氢原子直接相连,则该溴代烃的分子结构可能有A、1种 B、2种 C、3种 D、4种6. 第四周期元素的基态原子核外电子排布中,未成对电子最多可以有A、3个 B、4个 C、5个 D、6个7. 下列说法正确的是A、两个p轨道不能形成σ键,只能形成π键 B、2p、3p、4p能级的轨道数依次增多 C、2px、2py、2pz轨道相互垂直,但能量相等 D、电负性大于1.8的一定为非金属,小于1.8的一定为金属8. 下列物质中,与NaOH溶液、溶液、溴水都能反应的是A、 B、苯酚 C、 D、9. 下列各组物质中,化学键类型相同,形成的晶体类型也相同的是A、和 B、和 C、和 D、KCl和HCl10. 由有机化合物
 合成
合成 的合成路线中,不涉及的反应类型是( ) A、取代反应 B、加成反应 C、消去反应 D、氧化反应11. 通常状况下,是无色透明液体,下列对的有关叙述错误的是A、分子中的所有原子均达到8电子稳定结构 B、中P原子采用杂化 C、分子是极性分子 D、分子中四个原子共平面12. 能够用键能的大小作为主要依据来解释的是A、稀有气体一般难发生化学反应 B、分子比稳定 C、常温常压下氯气呈气态而溴单质星液态 D、C-H键的键能为 , 解离分子中C-H,需要放出能量为13. 下列说法正确的是A、和都是正四面体分子且键角都为 B、比稳定是由于分子之间存在氢键 C、乙醇分子与水分子之间只存在范德华力 D、氯的各种含氧酸的酸性由弱到强排列为14. 用下列装置(夹持仪器已略去)进行相关实验,装置正确且能达到实验目的的是
的合成路线中,不涉及的反应类型是( ) A、取代反应 B、加成反应 C、消去反应 D、氧化反应11. 通常状况下,是无色透明液体,下列对的有关叙述错误的是A、分子中的所有原子均达到8电子稳定结构 B、中P原子采用杂化 C、分子是极性分子 D、分子中四个原子共平面12. 能够用键能的大小作为主要依据来解释的是A、稀有气体一般难发生化学反应 B、分子比稳定 C、常温常压下氯气呈气态而溴单质星液态 D、C-H键的键能为 , 解离分子中C-H,需要放出能量为13. 下列说法正确的是A、和都是正四面体分子且键角都为 B、比稳定是由于分子之间存在氢键 C、乙醇分子与水分子之间只存在范德华力 D、氯的各种含氧酸的酸性由弱到强排列为14. 用下列装置(夹持仪器已略去)进行相关实验,装置正确且能达到实验目的的是 A、图1装置配制银氨溶液 B、图2分离乙醇和乙酸 C、图3除去甲烷中的乙烯 D、图4除去溴苯中的溴单质15. 某烃的结构如下图所示,下列关于该烃的说法正确的是
A、图1装置配制银氨溶液 B、图2分离乙醇和乙酸 C、图3除去甲烷中的乙烯 D、图4除去溴苯中的溴单质15. 某烃的结构如下图所示,下列关于该烃的说法正确的是 A、密度小于水且溶于水 B、分子中所有原子可能处于同一平面 C、与Br2等物质的量加成的产物有5种(不考虑立体结构) D、不存在含苯环的同分异构体16. 某有机化合物X的结构简式如图所示,下列说法错误的是
A、密度小于水且溶于水 B、分子中所有原子可能处于同一平面 C、与Br2等物质的量加成的产物有5种(不考虑立体结构) D、不存在含苯环的同分异构体16. 某有机化合物X的结构简式如图所示,下列说法错误的是 A、X的分子式为 B、X中含有两种官能团 C、X的核磁共振氢谱有五组峰 D、X能发生水解反应和加成反应17. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是A、28g聚丙烯中含有的碳原子数为NA B、1mol葡萄糖分子中含羟基个数为6NA C、38g正丁烷和20g异丁烷的混合物中共价键的数目为13NA D、100g质量分数为46%的酒精与足量钠反应,生成的分子数为0.5NA18. 一种杂环有机物M的结构如图所示,下列说法正确的是
A、X的分子式为 B、X中含有两种官能团 C、X的核磁共振氢谱有五组峰 D、X能发生水解反应和加成反应17. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是A、28g聚丙烯中含有的碳原子数为NA B、1mol葡萄糖分子中含羟基个数为6NA C、38g正丁烷和20g异丁烷的混合物中共价键的数目为13NA D、100g质量分数为46%的酒精与足量钠反应,生成的分子数为0.5NA18. 一种杂环有机物M的结构如图所示,下列说法正确的是 A、第一电离能: B、电负性: C、C原子的杂化方式有三种 D、π键与σ键个数比为4:2319. 铁的晶体有多种结构,其中两种晶体的晶胞结构如下图甲、乙所示(acm、bcm分别为晶胞边长),下列说法正确的是
A、第一电离能: B、电负性: C、C原子的杂化方式有三种 D、π键与σ键个数比为4:2319. 铁的晶体有多种结构,其中两种晶体的晶胞结构如下图甲、乙所示(acm、bcm分别为晶胞边长),下列说法正确的是 A、两种铁晶体中均存在金属阳离子和阴离子 B、乙晶体晶胞中所含有的铁原子数为14 C、甲、乙两种晶胞中铁原子的配位数之比为1:2 D、甲、乙两种铁晶体的密度比为b3:2a320. 化合物M是合成某药物的中间体,其结构如图所示。下列关于化合物M的说法错误的是
A、两种铁晶体中均存在金属阳离子和阴离子 B、乙晶体晶胞中所含有的铁原子数为14 C、甲、乙两种晶胞中铁原子的配位数之比为1:2 D、甲、乙两种铁晶体的密度比为b3:2a320. 化合物M是合成某药物的中间体,其结构如图所示。下列关于化合物M的说法错误的是 A、M分子中含2个手性碳原子 B、苯环上的一氯代物有6种 C、1molM可与7molH2发生加成反应 D、既能与金属钠反应,又能与NaOH溶液反应
A、M分子中含2个手性碳原子 B、苯环上的一氯代物有6种 C、1molM可与7molH2发生加成反应 D、既能与金属钠反应,又能与NaOH溶液反应二、非选择题
-
21. 下表为元素周期表前三周期的一部分:
X
R
Y
Z
W
(1)、基态Z原子的价电子排布式为。(2)、X与Y的简单氢化物中沸点较高的是(填化学式),原因是。(3)、选出X的基态原子的电子排布图(填“①”或“②”),另一电子排布图不能作为基态原子的电子排布图是因为它不符合(填标号)。①
 ②
②
A.能量最低原理 B.泡利原理 C.洪特规则
(4)、以上五种元素中,(填元素符号)元素第一电离能最大,与分子中键角较大的是(填分子式)。(5)、已知Z、W可形成分子 , 且Z、W原子均满足稳定结构,则的结构式为 , Z原子的杂化方式为。22. 在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的离子反应方程式:。回答下列问题:(1)、写出基态的核外电子排布式:。(2)、配离子中心原子的配位数为 , 配位原子为。(3)、经测定发现,固体由和两种离子组成,的空间构型为;与互为等电子体的分子有(写出一种)。(4)、石墨可作润滑剂,其主要原因是。(5)、一种金铜合金晶体具有面心立方最密堆积结构,其晶胞如图A所示。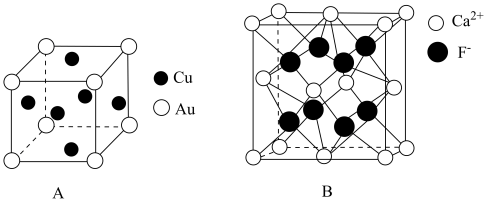
①该晶体中金属原子之间的作用力为。
②该晶体具有储氢功能,氢原子可进入到由Cu原子和Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与(如图B)的结构相似,该晶体储氢后的化学式为。
③已知该合金密度为 , 铜的原子半径为127.8pm,阿伏加德罗常数值为NA , 则Au原子半径r(Au)= =pm(列出计算式)。
23. 己二酸(HOOCCH2CH2CH2CH2COOH)是一种工业上有重要意义的二元酸,实验室利用环己醇( )合成己二酸的反应原理为:
)合成己二酸的反应原理为: +8HNO3→HOOCCH2CH2CH2CH2COOH+8NO2↑+5H2O
+8HNO3→HOOCCH2CH2CH2CH2COOH+8NO2↑+5H2O 实验装置如下图:

可能用到的有关数据如下表所示:
物质
熔点/℃
沸点/℃
溶解性
相对分子质量
环己醇
25.9
160.8
20℃时水中溶解度为3.6g,可溶于乙醇、苯
100
己二酸
152
337.5
在水中溶解度:15℃时为1.44g,25℃时为2.3g,易溶于乙醇,不溶于苯
146
实验步骤如下:
①在三口烧瓶中加入50mL50%硝酸(密度为),再加入1~2粒沸石,滴液漏斗中盛放5.4mL(5.2g)环己醇。
②水浴加热三口烧瓶至50℃左右,移去水浴,逐滴加入5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩余的环己醇,维持反应温度在60~65℃之间。
③当环己醇全部加入后,将混合物用80~90℃水浴加热约10min(注意控制温度),直至____为止。
④趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
⑤粗产品经提纯后称重为5.2g。
回答下列问题:
(1)、仪器B的名称为。(2)、步骤②环己醇要逐滴滴加的原因是。(3)、步骤③中,停止加热的判断依据是。(4)、烧杯中NaOH溶液的作用是(用离子方程式表示)。(5)、步骤④中为了除去可能的杂质和减少产品损失,可分别用冰水和洗涤晶体。(6)、粗产品可用法(填实验操作名称)提纯。(7)、本实验所得己二酸产率为。(保留一位小数)24. 手性分子无论是对于生命还是科学都有着巨大的意义。有机化合物M就是一种手性分子,M的一种合成路径如图所示。

 D
D




已知:①NaBH4是一种选择性还原剂;
②
 +R2CHO
+R2CHO
回答下列问题:
(1)、A的化学名称为 , B的结构简式为。(2)、D生成E的反应类型为 , F中官能团的名称是。(3)、写出E→F反应的化学方程式:。(4)、芳香化合物H是M的同分异构体,只含羰基或醛基一种官能团,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为6:2:1,写出1种符合要求的H的结构简式:。(5)、设计 和
和 为主要起始原料制备
为主要起始原料制备 的合成路线:(无机试剂任选)。
的合成路线:(无机试剂任选)。