广东省广州市荔湾区2021-2022学年高二下学期期末考试化学试题
试卷更新日期:2023-04-17 类型:期末考试
一、单选题
-
1. 下列说法中正确的是A、在多电子原子中,p道电子能量一定高于s轨道电子能量 B、2p和3p轨道形状均为哑铃形 C、基态氮原子的轨道表示式为
 D、B原子由1s22s22p→1s22s22p时,由基态转化为激发态,形成发射光谱
2. 下列说法正确的是A、某分子由X和Y原子构成,个数比为1:2,则X原子一定为sp2杂化 B、元素Ga的核外电子排布式为[Ar]4s24p1 , 位于元素周期表中p区 C、NH3中N-H间的键角比CH4中C-H间的键角大 D、基态Cr原子有6个未成对电子3. 现有四种元素的基态原子的电子排布式如下:
D、B原子由1s22s22p→1s22s22p时,由基态转化为激发态,形成发射光谱
2. 下列说法正确的是A、某分子由X和Y原子构成,个数比为1:2,则X原子一定为sp2杂化 B、元素Ga的核外电子排布式为[Ar]4s24p1 , 位于元素周期表中p区 C、NH3中N-H间的键角比CH4中C-H间的键角大 D、基态Cr原子有6个未成对电子3. 现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
A、第一电离能:④>③>②>① B、原子半径:④>③>②>① C、电负性:④>③>②>① D、最高正化合价:④>③=②>①4. 有关晶体的结构如图所示,下列说法中错误的是 A、在金刚石晶体中,碳原子与碳碳键个数之比为1:2 B、该气态团簇分子的分子式为EF或FE C、在NaCl晶体中,距Na+最近的Cl-形成正八面体形 D、在CaF2晶体中,每个晶胞平均占有4个Ca2+5. 下列关于丙烯(CH3CH=CH2)分子的说法中,错误的是A、有8个σ键,1个π键 B、丙烯分子中的碳原子有sp3和sp2两种杂化类型 C、所有原子都在同一平面上 D、丙烯的键线式为
A、在金刚石晶体中,碳原子与碳碳键个数之比为1:2 B、该气态团簇分子的分子式为EF或FE C、在NaCl晶体中,距Na+最近的Cl-形成正八面体形 D、在CaF2晶体中,每个晶胞平均占有4个Ca2+5. 下列关于丙烯(CH3CH=CH2)分子的说法中,错误的是A、有8个σ键,1个π键 B、丙烯分子中的碳原子有sp3和sp2两种杂化类型 C、所有原子都在同一平面上 D、丙烯的键线式为 6. 自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。如图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法正确的是
6. 自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。如图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法正确的是 A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长)7. 三硝酸六尿素合铁[Fe(H2NCONH2)6](NO3)3]是常见的有机铁肥,一定条件下可由Fe(NO3)3和尿素(H2NCONH2)合成。下列说法正确的是A、NO的空间构型为V形 B、第一电离能:O>N>C>Fe C、尿素分子中碳为手性碳原子 D、尿素水溶液中存在尿素分子与水分子形成的氢键8. 下列说法正确的是A、
A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长)7. 三硝酸六尿素合铁[Fe(H2NCONH2)6](NO3)3]是常见的有机铁肥,一定条件下可由Fe(NO3)3和尿素(H2NCONH2)合成。下列说法正确的是A、NO的空间构型为V形 B、第一电离能:O>N>C>Fe C、尿素分子中碳为手性碳原子 D、尿素水溶液中存在尿素分子与水分子形成的氢键8. 下列说法正确的是A、 的一溴代物和
的一溴代物和 的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物
的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
D、
的名称是2,3,4-三甲基-2-乙基戊烷
D、 和
和 互为同系物
9. 下列关于有机化合物的说法正确的是A、石油的分馏、煤的干馏、煤的气化和液化均属于物理变化 B、聚合物(
互为同系物
9. 下列关于有机化合物的说法正确的是A、石油的分馏、煤的干馏、煤的气化和液化均属于物理变化 B、聚合物( )可由单体CH3CH=CH2和CH2=CH2加聚制得
C、香叶醇(
)可由单体CH3CH=CH2和CH2=CH2加聚制得
C、香叶醇( )能发生加成反应不能发生取代反应
D、油脂、淀粉、纤维素、蛋白质均为高分子化合物
10. 紫花前胡醇(如图)可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是
)能发生加成反应不能发生取代反应
D、油脂、淀粉、纤维素、蛋白质均为高分子化合物
10. 紫花前胡醇(如图)可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是 A、属于芳香烃衍生物 B、不能使酸性重铬酸钾溶液变色 C、能发生水解反应 D、能够发生消去反应生成双键11. 类比法是化学学习中的常用方法,下列类比关系正确的是A、干冰是分子晶体,则二氧化硅也是分子晶体 B、苯不能使酸性KMnO4溶液褪色,则甲苯也不能使酸性KMnO4溶液褪色 C、乙醇与浓硫酸在加热时能脱水生成乙烯,则丙醇与浓硫酸在加热时也能脱水生成丙烯 D、分子式为C7H7Br的芳香族化合物的同分异构体有4种,则分子式为C7H8O的芳香族化合物的同分异构体也是4种12. 下列实验操作可以达到实验目的的是
A、属于芳香烃衍生物 B、不能使酸性重铬酸钾溶液变色 C、能发生水解反应 D、能够发生消去反应生成双键11. 类比法是化学学习中的常用方法,下列类比关系正确的是A、干冰是分子晶体,则二氧化硅也是分子晶体 B、苯不能使酸性KMnO4溶液褪色,则甲苯也不能使酸性KMnO4溶液褪色 C、乙醇与浓硫酸在加热时能脱水生成乙烯,则丙醇与浓硫酸在加热时也能脱水生成丙烯 D、分子式为C7H7Br的芳香族化合物的同分异构体有4种,则分子式为C7H8O的芳香族化合物的同分异构体也是4种12. 下列实验操作可以达到实验目的的是实验目的
实验操作
A
验证乙烯能被酸性高锰酸钾溶液氧化
将乙醇与浓硫酸加热到170℃,反应生成的气体直接通入酸性高锰酸钾溶液,观察溶液是否褪色
B
除去苯中少量的苯酚
向苯和苯酚的混合液中加入浓溴水,充分反应后过滤
C
除去乙酸乙酯中混有的少量乙酸
加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体
D
检验蔗糖的水解产物
取少量蔗糖溶液,与稀硫酸共热后加入新制的Cu(OH)2悬浊液,观察是否出现砖红色沉淀
A、A B、B C、C D、D13. 化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
下列有关化合物X、Y和Z的说法错误的是( )
A、X分子中不含手性碳原子 B、Y分子中的碳原子可能处于同一平面 C、Z在浓硫酸催化下加热可发生消去反应 D、X、Z分别在过量NaOH溶液中加热,均能生成丙三醇14. 设NA为阿伏加德罗常数值。下列有关叙述正确的是( )A、14g乙烯和丙烯混合气体中的氢原子数为2NA B、1mol甲烷中的氢原子被氯原子完全取代,需要氯气分子数为2NA C、92.0g甘油(丙三醇)中含有羟基数为1.0NA D、标准状况下,2.24LCCl4含有的共价键数为0.4NA15. 解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键强弱无关的变化规律是A、HF、HCl、HBr、HI的热稳定性依次减弱 B、NaF、NaCl、NaBr、NaI的熔点依次降低 C、SiF4、SiCl4、SiBr4、SiI4的熔、沸点逐渐升高 D、Li、Na、K、Rb的熔点逐渐降低16. 短周期主族元素X、Y、Z、W原子序数依次增大,四种元素组成的一种食品添加剂结构如图所示,Z的原子半径在短周期中最大,W基态原子的s能级电子总数是p能级电子总数的2/3。
下列说法错误的是
A、Y、Z形成的简单离子半径: Y> Z B、W、Y形成的简单氢化物沸点: Y > W C、Z分别与X、Y形成的化合物中所含化学键类型一定完全相同 D、WX3、X2Y中W原子和Y原子的杂化轨道类型相同17. 下列说法正确的组合是( )①晶体在不同方向上的硬度、导热性、导电性相同
②离子晶体都是化合物
③共价晶体中,共价键越强,熔点越高
④分子晶体中,分子间作用力越大,对应的物质越稳定
⑤金属晶体能导电的原因是在外加电场作用下可失去电子
⑥分子识别是超分子的重要特征之一
A、①②③ B、①④⑤ C、②③⑥ D、②④⑥18. 以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是 ABC
ABC A、A的结构简式是
A、A的结构简式是 B、①②的反应类型分别是取代反应、消去反应
C、反应②的条件是浓硫酸加热
D、加入酸性KMnO4溶液,若溶液褪色则可证明
B、①②的反应类型分别是取代反应、消去反应
C、反应②的条件是浓硫酸加热
D、加入酸性KMnO4溶液,若溶液褪色则可证明 已完全转化为
已完全转化为 19. 我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列相关说法正确的是
19. 我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列相关说法正确的是 A、黄芩素分子式为 B、分子中有3种含氧官能团,在空气中不易被氧化 C、黄芩素的核磁共振氢谱显示有八组峰 D、0.1mol黄芩素与完全加成需要20. 我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如图。
A、黄芩素分子式为 B、分子中有3种含氧官能团,在空气中不易被氧化 C、黄芩素的核磁共振氢谱显示有八组峰 D、0.1mol黄芩素与完全加成需要20. 我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如图。
下列说法正确的是
A、过程①发生了取代反应 B、中间产物M的结构简式为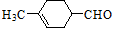 C、利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D、1mol对二甲苯可以和3molH2加成,加成产物的一氯代物只有2种
C、利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D、1mol对二甲苯可以和3molH2加成,加成产物的一氯代物只有2种
二、非选择题
-
21. 前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
A
基态A原子核外电子占据3个轨道
B
原子核外有6种运动状态不同的电子
C
元素原子的核外p电子数比s电子数少1个
D
基态原子核外有6个原子轨道排有电子,且只有1个未成对电子
E
基态E+各能级电子全充满
(1)、元素A、E的元素符号分别是: , D元素基态原子的电子排布式。(2)、元素A、B、C的最高价氧化物对应的水化物酸性依次增强,其原因是。(3)、实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构。其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为 , 该化合物熔点金刚石(填“高于”或“低于”)。(4)、判断下列分子或离子中空间构型是V形的是____(填写序号)A、CO2 B、H3O+ C、NO D、NO22. 2021年全世界前沿新材料领域取得新的进展。推动了高技术产业变革,钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:(1)、钛的核外电子排布式是;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛元素的检验方法如图:
TiO2+可与H2O2形成配离子[TiO(H2O2)]2+ , 其原因是。
(3)、二氧化钛(TiO2)是一种常用的、具有较高催化活性和稳定性的光催化剂,也常用于污水处理。纳米TiO2催化的一个实例如图所示:

化合物乙中采取sp3方式杂化的原子对应的元素的第一电离能由大到小的顺序为。化合物乙的分子中采取sp3杂化方式成键的原子数目是个。
(4)、氮化钛晶体的晶胞结构如图所示,则氮化钛晶体化学式为 , 该晶体结构中与N原子距离最近且相等的N原子有个;该晶胞的密度dg/cm3 , 则晶胞结构中两个氮原子之间的最近距离为。(NA为阿伏加德罗常数的数值,1pm=10-12m,只列计算式) 23. 按要求填空。(1)、测定有机物M(
23. 按要求填空。(1)、测定有机物M( )的相时分子质量的光谱为(填代号)。
)的相时分子质量的光谱为(填代号)。A..红外光谱 B.质谱 C.核磁共振氢谱
M的分子式为;写出M在一定条件下与氧气发生催化氧化的反应方程式:。
(2)、两分子 与浓硫酸共热发生脱水反应生成六元环状酯C6H8O4 , 该反应的化学方程式为。 (3)、合成高分子的基本方法包括加聚反应和缩聚反应。写出有机物
与浓硫酸共热发生脱水反应生成六元环状酯C6H8O4 , 该反应的化学方程式为。 (3)、合成高分子的基本方法包括加聚反应和缩聚反应。写出有机物 在一定条件下发生加聚反应的化学方程式。 (4)、已知共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物,例如
在一定条件下发生加聚反应的化学方程式。 (4)、已知共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物,例如 +
+  →
→ 。在一定条件下,化合物
。在一定条件下,化合物 和化合物
和化合物 能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式。 24. 双氯芬酸钠(化合物H)是一种抗炎镇痛类药物,其一种合成方法如图:
能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式。 24. 双氯芬酸钠(化合物H)是一种抗炎镇痛类药物,其一种合成方法如图:
已知:

 (1)、A的化学名称为。(2)、写出反应②的化学方程式:。(3)、C中所含官能团的名称为。(4)、反应④的反应类型为 , E的结构。(5)、化合物I是
(1)、A的化学名称为。(2)、写出反应②的化学方程式:。(3)、C中所含官能团的名称为。(4)、反应④的反应类型为 , E的结构。(5)、化合物I是 的同系物,相对分子质量比
的同系物,相对分子质量比 多28,其苯环上有三个取代基的同分异构体共有种(不考虑立体异构),其中核磁共振氢谱有四组峰,峰面积之比为6:2:2:1的为(写出其中的一种的结构简式)。 (6)、根据上述信息,写出以苯和CH3COCl为原料合成
多28,其苯环上有三个取代基的同分异构体共有种(不考虑立体异构),其中核磁共振氢谱有四组峰,峰面积之比为6:2:2:1的为(写出其中的一种的结构简式)。 (6)、根据上述信息,写出以苯和CH3COCl为原料合成 的路线。(无机试剂任选,合成路线流程图示例见本题题干)
的路线。(无机试剂任选,合成路线流程图示例见本题题干)