河南省平顶山市2023年中考一模化学试题
试卷更新日期:2023-04-17 类型:中考模拟
一、单选题
-
1. 下列过程不涉及化学变化的是( )A、石油分馏 B、高粱酿酒 C、钢铁生锈 D、彩陶烧制2. 从环境保护的角度考虑,下列燃料中最理想的是( )A、煤 B、汽油 C、氢气 D、天然气3. 平顶山地区特色物产丰富。下列食材或食品中富含蛋白质的是( )A、鲁山血桃 B、舞钢豆腐 C、叶县岩盐 D、汝州粉皮4. 水是化学学习和研究的重要物质。下列关于水的叙述正确的是( )A、水与冰块混合得到混合物 B、农业上可采用漫灌节约用水 C、用肥皂水可以将硬水转化为软水 D、水电解时所产生的氢气和氧气的质量比为1:85. 下列实验操作错误的是( )A、
 检查气密性
B、
检查气密性
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 测定溶液pH
D、
测定溶液pH
D、 过滤
6. 下列化肥中,加入熟石灰研磨能产生刺激性气味气体的是( )A、CO(NH2)2 B、KNO3 C、Ca3(PO4)2 D、NH4Cl7. 物质是由微观粒子构成。下列物质中由分子构成的是( )A、氨 B、金刚石 C、氯化钠 D、汞8. 分类法是化学学习和研究的重要方法之一。下列分类正确的是( )A、有机物:碳酸钙、甲烷 B、合成材料:铝合金、合成纤维 C、碱:纯碱、烧碱 D、氧化物:水、干冰9. 化学是以实验为基础的学科。下列有关实验现象的描述正确的是( )A、红磷在空气中燃烧产生大量白雾 B、将生石灰溶于水中后溶液温度升高 C、向硫酸铜溶液中滴加氯化钡溶液,产生蓝色沉淀 D、铁丝在氧气中燃烧,火星四射,生成四氧化三铁10. 如图是M、N 两种固体物质的溶解度曲线,下列说法错误的是( )
过滤
6. 下列化肥中,加入熟石灰研磨能产生刺激性气味气体的是( )A、CO(NH2)2 B、KNO3 C、Ca3(PO4)2 D、NH4Cl7. 物质是由微观粒子构成。下列物质中由分子构成的是( )A、氨 B、金刚石 C、氯化钠 D、汞8. 分类法是化学学习和研究的重要方法之一。下列分类正确的是( )A、有机物:碳酸钙、甲烷 B、合成材料:铝合金、合成纤维 C、碱:纯碱、烧碱 D、氧化物:水、干冰9. 化学是以实验为基础的学科。下列有关实验现象的描述正确的是( )A、红磷在空气中燃烧产生大量白雾 B、将生石灰溶于水中后溶液温度升高 C、向硫酸铜溶液中滴加氯化钡溶液,产生蓝色沉淀 D、铁丝在氧气中燃烧,火星四射,生成四氧化三铁10. 如图是M、N 两种固体物质的溶解度曲线,下列说法错误的是( ) A、M的溶解度受温度影响较大 B、20℃时,M、N的溶解度相同 C、40℃时,将35gM加入50g水中所得溶液的质量为85g D、40℃时,M、N饱和溶液溶质质量分数大小关系是M>N11. 火力发电厂用石灰浆吸收废气中的SO2: , 则X为( )A、CaSO4 B、CaSO3 C、CaS D、CaS2O312. 下列实验方案中,实验设计不能达到实验目的的是( )
A、M的溶解度受温度影响较大 B、20℃时,M、N的溶解度相同 C、40℃时,将35gM加入50g水中所得溶液的质量为85g D、40℃时,M、N饱和溶液溶质质量分数大小关系是M>N11. 火力发电厂用石灰浆吸收废气中的SO2: , 则X为( )A、CaSO4 B、CaSO3 C、CaS D、CaS2O312. 下列实验方案中,实验设计不能达到实验目的的是( )方案
实验目的
实验设计
A
区分羊毛和涤纶
分别灼烧闻气味
B
除去铁粉中的铜粉
加入足量稀硫酸,过滤、洗涤、干燥
C
比较铜片和黄铜片的硬度
相互刻画
D
检验集气瓶中的气体是否为氧气
将带火星木条伸入集气瓶中
A、A B、B C、C D、D13. 一定条件下,下列物质间的转化可以一步实现的是( )A、CuO→Cu(OH)2 B、NaNO3→Na2SO4 C、Na2CO3→NaOH D、Fe2O3→FeCl214. 镁铝合金xg与足量的稀盐酸反应后,经测定生成0.1g氢气,则x可能为( )A、1.2 B、1.1 C、0.9 D、无法确定二、填空题
-
15. 空气中含量多且常用作保护气的是;地壳中含量最多的元素是;84消毒液是常见的含氯消毒剂,其有效成分是NaClO,则氯元素的化合价为。16. 铁钉生锈主要是铁与空气中的反应的结果;使燃料充分燃烧,应考虑的因素是(写一条即可);酒精完全燃烧的化学方程式为。17. 如图是某原子的结构示意图。则x表示;若x=11时,y的值为 , 该元素位于元素周期表中第三周期的(填“最左边”、“中间”或“最右边”)。
 18. 下图为某反应的微观示意图。
18. 下图为某反应的微观示意图。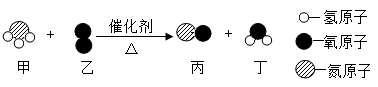
该反应的化学方程式为;图中两种氧化物的质量比为。
19. 现有6.4g未知物质,将其和氧气充分反应,经测定生成4.4g二氧化碳,2.8g一氧化碳和7.2g水,则参加反应氧气的质量是g,生成的二氧化碳和一氧化碳的分子个数之比为。三、综合题
-
20. 已知A、B、C、D是四种不同类别的物质,它们有如图的转化关系(部分物质和反应条件略去)。A是年产量最高的金属;D的水溶液呈蓝色,常用于配制农药波尔多液。则B的化学式为;C的一种用途是;溶液中发生的一个置换反应的化学方程式为。
 21. 请从微观角度解释下列问题。(1)、湿衣服在阳光下比在阴凉处干得快。(2)、CO和CO2都是由碳、氧元素组成,但CO常做燃料,CO2可用来灭火。22. 设计对比实验是化学研究常用的方法。下图是化学小组设计的燃烧条件的探究实验。
21. 请从微观角度解释下列问题。(1)、湿衣服在阳光下比在阴凉处干得快。(2)、CO和CO2都是由碳、氧元素组成,但CO常做燃料,CO2可用来灭火。22. 设计对比实验是化学研究常用的方法。下图是化学小组设计的燃烧条件的探究实验。 (1)、将注射器中的溶液缓缓推人V形管,请写出有关反应的化学方程式。(2)、同时加热盛有红磷和白磷的W形管到100℃时,发现白磷燃烧而红磷不燃烧。则由此说明燃烧的条件是什么?23. 下图装置可以做CO还原Fe3O4的实验并检验该反应的气体生成物。已知CO中混有杂质CO2和H2O。
(1)、将注射器中的溶液缓缓推人V形管,请写出有关反应的化学方程式。(2)、同时加热盛有红磷和白磷的W形管到100℃时,发现白磷燃烧而红磷不燃烧。则由此说明燃烧的条件是什么?23. 下图装置可以做CO还原Fe3O4的实验并检验该反应的气体生成物。已知CO中混有杂质CO2和H2O。 (1)、写出C装置玻璃管内发生反应的化学方程式。(2)、从环保角度考虑,写出一种尾气的处理方法。(3)、如何验证实验后的A装置中仍含有氢氧化钠?(写出操作步骤、现象和结论)24. 除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。(1)、请写出以上操作的合理顺序(数字序号不能重复使用)。(2)、过滤中玻璃棒的作用是什么?(3)、请写出加盐酸后反应的化学方程式。(写出一个即可)25. 酸、碱、盐种类繁多,它们与人类日常生活和工农业生产关系十分密切。(1)、酸具有相似的性质,因为不同的酸在水溶液中都能解离出(填字母)。
(1)、写出C装置玻璃管内发生反应的化学方程式。(2)、从环保角度考虑,写出一种尾气的处理方法。(3)、如何验证实验后的A装置中仍含有氢氧化钠?(写出操作步骤、现象和结论)24. 除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加过量的NaOH溶液;②加过量的BaCl2溶液;③过滤;④加适量的盐酸;⑤加过量的Na2CO3溶液。(1)、请写出以上操作的合理顺序(数字序号不能重复使用)。(2)、过滤中玻璃棒的作用是什么?(3)、请写出加盐酸后反应的化学方程式。(写出一个即可)25. 酸、碱、盐种类繁多,它们与人类日常生活和工农业生产关系十分密切。(1)、酸具有相似的性质,因为不同的酸在水溶液中都能解离出(填字母)。a.H2O b.H2 c.H+ d.OH-
(2)、中和反应是化学学习和研究的重要内容。如图是氢氧化钠溶液与盐酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将(填“氢氧化钠溶液”或“盐酸”)滴加到另一种溶液中。
②滴入溶液体积为V2mL时,溶液中的溶质为。
(3)、氯化钠是生活中常见的盐。实验室用氯化钠固体配制40g质量分数为8%的溶液,则所需氯化钠固体的质量为;若其他操作正确,量取水时俯视读数,对结果(溶质的质量分数)会造成的影响是。(填“偏大”、“偏小”或“不变”)(4)、某同学在Al(NO3)2、Cu(NO3)2和AgNO3的混合溶液中加入一定质量的锌粉,充分反应后过滤,发现滤液仍呈蓝色。①写出一定发生反应的化学方程式。
②分析滤液中溶质的成分。
(5)、某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液60g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?