【高考真题】2022年重庆高考真题化学试题
试卷更新日期:2023-04-13 类型:高考真卷
一、选择题
-
1. “逐梦苍穹之上,拥抱星辰大海”,航天科技的发展与化学密切相关。下列选项正确的是( )
 A、“北斗三号”导航卫星搭载计时铷原子钟,铷是第ⅠA族元素 B、“嫦娥五号”探测器配置砷化镓太阳能电池,太阳能电池将化学能直接转化为电能 C、“祝融号”火星车利用正十一烷储能,正十一烷属于不饱和烃 D、“神舟十三号”航天员使用塑料航天面窗,塑料属于无机非金属材料2. BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是( )A、Cl的原子结构示意图为
A、“北斗三号”导航卫星搭载计时铷原子钟,铷是第ⅠA族元素 B、“嫦娥五号”探测器配置砷化镓太阳能电池,太阳能电池将化学能直接转化为电能 C、“祝融号”火星车利用正十一烷储能,正十一烷属于不饱和烃 D、“神舟十三号”航天员使用塑料航天面窗,塑料属于无机非金属材料2. BCl3水解反应方程式为:BCl3+3H2O=B(OH)3+3HCl,下列说法错误的是( )A、Cl的原子结构示意图为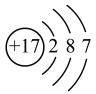 B、H2O的空间填充模型为
B、H2O的空间填充模型为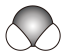 C、BCl3的电子式为:
C、BCl3的电子式为: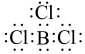 D、B(OH)3的结构简式为
D、B(OH)3的结构简式为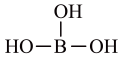 3. 下列叙述正确的是( )A、Cl2和Br2分别与Fe2+反应得到Cl-和Br- B、Na和Li分别在O2中燃烧得到Na2O和Li2O C、1molSO3与1molNO2分别通入1L水中可产生相同浓度的H2SO4和HNO3 D、0.1mol•L-1醋酸和0.1mol•L-1硼酸分别加入适量Na2CO3中均可得到CO2和H2O4. 下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO等离子大量共存的是( )A、加入ZnSO4 B、加入Fe粉 C、通入NH3 D、通入CO25. 工业上用N2和H2合成NH3 , NA代表阿伏加德罗常数的值,下列说法正确的是( )A、消耗14gN2生成NH3分子数为2 NA B、消耗1molH2 , 生成N-H键数为2 NA C、生成标准状况下22.4LNH3 , 电子转移数为2 NA D、氧化1molNH3生成NO,需O2分子数为2 NA6. 关于M的说法正确的是( )
3. 下列叙述正确的是( )A、Cl2和Br2分别与Fe2+反应得到Cl-和Br- B、Na和Li分别在O2中燃烧得到Na2O和Li2O C、1molSO3与1molNO2分别通入1L水中可产生相同浓度的H2SO4和HNO3 D、0.1mol•L-1醋酸和0.1mol•L-1硼酸分别加入适量Na2CO3中均可得到CO2和H2O4. 下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO等离子大量共存的是( )A、加入ZnSO4 B、加入Fe粉 C、通入NH3 D、通入CO25. 工业上用N2和H2合成NH3 , NA代表阿伏加德罗常数的值,下列说法正确的是( )A、消耗14gN2生成NH3分子数为2 NA B、消耗1molH2 , 生成N-H键数为2 NA C、生成标准状况下22.4LNH3 , 电子转移数为2 NA D、氧化1molNH3生成NO,需O2分子数为2 NA6. 关于M的说法正确的是( ) A、分子式为C12H16O6 B、含三个手性碳原子 C、所有氧原子共平面 D、与(CH3)2C=O互为同系物7. 下列实验装置(夹持装置略)及操作正确的是( )
A、分子式为C12H16O6 B、含三个手性碳原子 C、所有氧原子共平面 D、与(CH3)2C=O互为同系物7. 下列实验装置(夹持装置略)及操作正确的是( ) A、装置甲气体干燥 B、装置乙固液分离 C、装置丙Cl2制备 D、装置丁pH测试8. PEEK是一种特种高分子材料,可由X和Y在一定条件下反应制得,相应结构简式如图。下列说法正确的是( )
A、装置甲气体干燥 B、装置乙固液分离 C、装置丙Cl2制备 D、装置丁pH测试8. PEEK是一种特种高分子材料,可由X和Y在一定条件下反应制得,相应结构简式如图。下列说法正确的是( )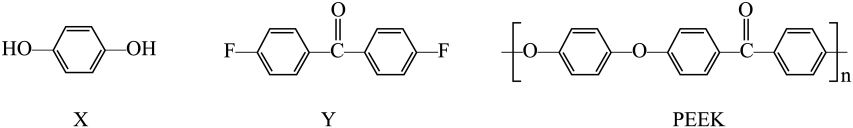 A、PEEK是纯净物 B、X与Y经加聚反应制得PEEK C、X苯环上H被Br所取代,一溴代物只有一种 D、1molY与H2发生加成反应,最多消耗6molH29. 下列实验操作及现象与对应结论不匹配的是( )
A、PEEK是纯净物 B、X与Y经加聚反应制得PEEK C、X苯环上H被Br所取代,一溴代物只有一种 D、1molY与H2发生加成反应,最多消耗6molH29. 下列实验操作及现象与对应结论不匹配的是( )选项
实验操作及现象
结论
A
将Na2S2O3溶液和稀H2SO4混合,得到沉淀,且生成的气体可使品红溶液褪色
Na2S2O3既体现还原性又体现氧化性
B
将Zn(OH)2固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液
Zn(OH)2既体现碱性又体现酸性
C
将TiCl4液体和FeCl3固体分别暴露在潮湿空气中,只有前者会冒“白烟”
水解性:TiCl4>FeCl3
D
将红色固体CrO3加热,得到绿色固体Cr2O3 , 且生成的气体可以使带火星的木条复燃
热稳定性:CrO3<Cr2O3
A、A B、B C、C D、D10. R、X、Y、Z均为短周期主族元素,Y与Z同主族且Z的原子序数大于Y。R和X的原子获得1个电子均可形成稀有气体原子的电子层结构,R的最高化合价为+1。1mol化合物RZY3X含58mol电子。下列说法正确的是( )A、R与X形成的化合物水溶液呈碱性 B、X是四种元素中原子半径最大的 C、Y单质的氧化性比Z单质的弱 D、Z的原子最外层电子数为611. 某小组模拟成垢-除垢过程如图。100mL0.1mol•L-1CaCl2水溶液……
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A、经过步骤①,溶液中c(Ca2+)+c(Na+)=c(Cl-) B、经过步骤②,溶液中c(Na+)=4c(SO) C、经过步骤②,溶液中c(Cl-)=c(CO)+c(HCO)+c(H2CO3) D、经过步骤③,溶液中c(CH3COOH)+c(CH3COO-)=c(Cl-)12. 硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。
下列说法错误的是( )
A、惰性电极2为阳极 B、反应前后WO/WO数量不变 C、消耗1mol氧气,可得到1mol硝酮 D、外电路通过1mol电子,可得到1mol水13. “千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得△H4/(kJ•mol-1)为( ) A、+533 B、+686 C、+838 D、+114314. 两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
A、+533 B、+686 C、+838 D、+114314. 两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。反应1:NH4HCO3(s)NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa
反应2:2NaHCO3(s)Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )
A、反应2的平衡常数为4×106Pa2 B、通入NH3 , 再次平衡后,总压强增大 C、平衡后总压强为4.36×105Pa D、缩小体积,再次平衡后总压强不变二、非选择题
-
15. 电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。

Sn与Si同族,25℃时相关的溶度积见表。
化学式
Sn(OH)4(或SnO2·2H2O)
Fe(OH)3
Cu(OH)2
溶度积
1.0×10-56
4×10-38
2.5×10-20
(1)、Na2SnO3的回收①产品Na2SnO3中Sn的化合价是。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+ , 且无气体生成,则生成的硝酸盐是 , 废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2 , 焙烧时,与NaOH反应的化学方程式为。
(2)、滤液1的处理①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于mol•L-1。
(3)、产品中锡含量的测定称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+ , 再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO被还原为I— , 终点时消耗KIO3溶液20.00mL。
①终点时的现象为 , 产生I2的离子反应方程式为。
②产品中Sn的质量分数为%。
16. 研究小组以无水甲苯为溶剂,PCl5(易水解)和NaN3为反应物制备米球状红磷。该红磷可提高钠离子电池的性能。(1)、甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。
①存贮时,Na应保存在中。
②冷凝水的进口是(填“a”或“b”)。
③用Na干燥甲苯的原理是(用化学方程式表示)。
④回流过程中,除水时打开的活塞是;体系变蓝后,改变开关状态收集甲苯。
(2)、纳米球状红磷的制备装置如图2所示(搅拌和加热装置略)。
①在Ar气保护下,反应物在A装置中混匀后转入B装置,于280℃加热12小时,反应物完全反应。其化学反应方程式为。用Ar气赶走空气的目的是。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是和。
③所得纳米球状红磷的平均半径R与B装置中气体产物的压强p的关系如图3所示。欲控制合成R=125nm的红磷,气体产物的压强为kPa,需NaN3的物质的量为mol(保留3位小数)。已知:p=a×n,其中a=2.5×105kPa•mol-1 , n为气体产物的物质的量。
 17. 反应在工业上有重要应用。(1)、该反应在不同温度下的平衡常数如表所示。
17. 反应在工业上有重要应用。(1)、该反应在不同温度下的平衡常数如表所示。温度/℃
700
800
830
1000
平衡常数
1.67
1.11
1.00
0.59
①反应的△H0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是。
(2)、该反应常在Pd膜反应器中进行,其工作原理如图所示。
①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是。
②某温度下,H2在Pd膜表面上的解离过程存在如下平衡: , 其正反应的活化能远小于逆反应的活化能。下列说法错误的是。
A.Pd膜对气体分子的透过具有选择性
B.过程2的△H>0
C.加快Pd膜内H原子迁移有利于H2的解离
D.H原子在Pd膜表面上结合为H2的过程为放热反应
③同温同压下,等物质的量的CO和H2O通入无Pd膜反应器,CO的平衡转化率为75%;若换成Pd膜反应器,CO的平衡转化率为90%,则相同时间内出口a和出口b中H2的质量比为。
(3)、该反应也可采用电化学方法实现,反应装置如图所示。
①固体电解质采用(填“氧离子导体”或“质子导体”)。
②阴极的电极反应式为。
③同温同压下,相同时间内,若进口Ⅰ处n(CO):n(H2O)=a:b,出口Ⅰ处气体体积为进口Ⅰ处的y倍,则CO的转化率为(用a,b,y表示)。
18. 【选考题】配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。 (1)、基态Zn2+的电子排布式为。(2)、L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为形;每个L2-中采取sp2杂化的C原子数目为个,C与O之间形成σ键的数目为个。(3)、X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入____。(假设X晶胞形状不变)。A、-Cl B、-OH C、-NH2 D、-CH3(4)、X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(1)、基态Zn2+的电子排布式为。(2)、L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为形;每个L2-中采取sp2杂化的C原子数目为个,C与O之间形成σ键的数目为个。(3)、X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入____。(假设X晶胞形状不变)。A、-Cl B、-OH C、-NH2 D、-CH3(4)、X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于。
②X晶体中Zn2+的配位数为。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA , L2-与[Zn4O]6+的相对分子质量分别为M1和M2 , 则X的晶体密度为g•cm-3(列出化简的计算式)。
19. 【选考题】光伏组件封装胶膜是太阳能电池的重要材料,经由如图反应路线可分别制备封装胶膜基础树脂Ⅰ和Ⅱ(部分试剂及反应条件略)。反应路线Ⅰ:

反应路线Ⅱ:

已知以下信息:
①
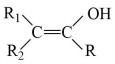
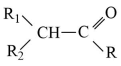
 (R、R1、R2为H或烃基)
(R、R1、R2为H或烃基)②
 +2ROH
+2ROH +H2O(1)、A+B→D的反应类型为。(2)、基础树脂Ⅰ中官能团的名称为。(3)、F的结构简式为。(4)、从反应路线Ⅰ中选择某种化合物作为原料H,且H与H2O反应只生成一种产物Ⅰ,则H的化学名称为。(5)、K与银氨溶液反应的化学方程式为;K可发生消去反应,其有机产物R的分子式为C4H6O,R及R的同分异构体同时满足含有碳碳双键和碳氧双键的有个(不考虑立体异构),其中核磁共振氢谱只有一组峰的结构简式为。(6)、L与G反应制备非体型结构的Q的化学方程式为。(7)、为满足性能要求,实际生产中可控制反应条件使F的支链不完全水解,生成的产物再与少量L发生反应,得到含三种链节的基础树脂Ⅱ,其结构简式可表示为。
+H2O(1)、A+B→D的反应类型为。(2)、基础树脂Ⅰ中官能团的名称为。(3)、F的结构简式为。(4)、从反应路线Ⅰ中选择某种化合物作为原料H,且H与H2O反应只生成一种产物Ⅰ,则H的化学名称为。(5)、K与银氨溶液反应的化学方程式为;K可发生消去反应,其有机产物R的分子式为C4H6O,R及R的同分异构体同时满足含有碳碳双键和碳氧双键的有个(不考虑立体异构),其中核磁共振氢谱只有一组峰的结构简式为。(6)、L与G反应制备非体型结构的Q的化学方程式为。(7)、为满足性能要求,实际生产中可控制反应条件使F的支链不完全水解,生成的产物再与少量L发生反应,得到含三种链节的基础树脂Ⅱ,其结构简式可表示为。