【高考真题】2022年福建省高考真题化学试题
试卷更新日期:2023-04-13 类型:高考真卷
一、单选题
-
1. 福建多个科研机构经过长期联合研究发现,使用和改性的基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是( )A、草酸属于无机物 B、与石墨互为同分异构体 C、属于过渡元素 D、催化剂通过降低焓变加快反应速率2. 络塞维是中药玫瑰红景天中含有的一种天然产物,分子结构见下图。关于该化合物下列说法正确的是( )
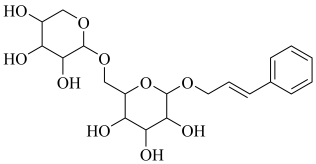 A、不能发生消去反应 B、能与醋酸发生酯化反应 C、所有原子都处于同一平面 D、络塞维最多能与反应3. 常温常压下,电化学还原制氨气的总反应方程式: , 设为阿伏加德罗常数的值,下列说法正确的是( )A、水中含有的孤电子对数为 B、每产生失去的电子数为 C、氨水中,含有的分子数少于 D、消耗(已折算为标况)时,产生的分子数为4. 某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍,Z为地壳中含量最多的元素。下列说法正确的是( )A、简单氢化物沸点: B、分子的空间构型为三角锥形 C、原子半径: D、最高价氧化物对应水化物的碱性:5. 探究醋酸浓度与电离度关系的步骤如下,与相关步骤对应的操作或叙述正确的( )
A、不能发生消去反应 B、能与醋酸发生酯化反应 C、所有原子都处于同一平面 D、络塞维最多能与反应3. 常温常压下,电化学还原制氨气的总反应方程式: , 设为阿伏加德罗常数的值,下列说法正确的是( )A、水中含有的孤电子对数为 B、每产生失去的电子数为 C、氨水中,含有的分子数少于 D、消耗(已折算为标况)时,产生的分子数为4. 某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍,Z为地壳中含量最多的元素。下列说法正确的是( )A、简单氢化物沸点: B、分子的空间构型为三角锥形 C、原子半径: D、最高价氧化物对应水化物的碱性:5. 探究醋酸浓度与电离度关系的步骤如下,与相关步骤对应的操作或叙述正确的( )步骤
操作或叙述
A
Ⅰ.用标准溶液标定醋酸溶液浓度
滴定时应始终注视滴定管中的液面
B
Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液
应使用干燥的容量瓶
C
Ⅲ.测定步骤Ⅱ中所得溶液的
应在相同温度下测定
D
Ⅳ.计算不同浓度溶液中醋酸的电离度
计算式为
A、A B、B C、C D、D6. 用铬铁合金(含少量单质)生产硫酸铬的工艺流程如下:
下列说法错误的是( )
A、“浸出”产生的气体含有 B、“除杂”的目的是除去元素 C、流程中未产生六价铬化合物 D、“滤渣2”的主要成分是7. 锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有和杂质离子,可在0~14范围内调节对其净化(即相关离子浓度)。时,与关系见下图(碱性过强时和会部分溶解)。下列说法正确的是( )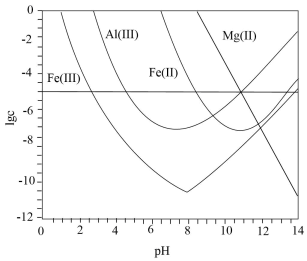 A、可被净化的区间最大 B、加入适量 , 可进一步提升净化程度 C、净化的先后顺序: D、8. 实验室需对少量污染物进行处理。以下处理方法和对应的反应方程式均错误的是( )A、用硫磺处理洒落在地上的水银: B、用盐酸处理银镜反应后试管内壁的金属银: C、用烧碱溶液吸收蔗糖与浓硫酸反应产生的刺激性气体: D、用烧碱溶液吸收电解饱和食盐水时阳极产生的气体:9. 一种化学“自充电”的锌-有机物电池,电解质为和水溶液。将电池暴露于空气中,某电极无需外接电源即能实现化学自充电,该电极充放电原理如下图所示。下列说法正确的是( )
A、可被净化的区间最大 B、加入适量 , 可进一步提升净化程度 C、净化的先后顺序: D、8. 实验室需对少量污染物进行处理。以下处理方法和对应的反应方程式均错误的是( )A、用硫磺处理洒落在地上的水银: B、用盐酸处理银镜反应后试管内壁的金属银: C、用烧碱溶液吸收蔗糖与浓硫酸反应产生的刺激性气体: D、用烧碱溶液吸收电解饱和食盐水时阳极产生的气体:9. 一种化学“自充电”的锌-有机物电池,电解质为和水溶液。将电池暴露于空气中,某电极无需外接电源即能实现化学自充电,该电极充放电原理如下图所示。下列说法正确的是( ) A、化学自充电时,增大 B、化学自充电时,电能转化为化学能 C、化学自充电时,锌电极反应式: D、放电时,外电路通过电子,正极材料损耗10. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:
A、化学自充电时,增大 B、化学自充电时,电能转化为化学能 C、化学自充电时,锌电极反应式: D、放电时,外电路通过电子,正极材料损耗10. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:①
②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与投入量(用x表示)的关系如下图所示。下列说法正确的是( )
 A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,
A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,二、非选择题
-
11. 粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含和等)提铝的工艺流程如下:

回答下列问题:
(1)、“浸出”时适当升温的主要目的是 , 发生反应的离子方程式为。(2)、“浸渣”的主要成分除残余外,还有。实验测得,粉煤灰(的质量分数为)经浸出、干燥后得到“浸渣”(的质量分数为),的浸出率为。(3)、“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入沉铝的目的是 , “沉铝”的最佳方案为。 (4)、“焙烧”时,主要反应的化学方程式为。(5)、“水浸”后得到的“滤液2”可返回工序循环使用。12. 某兴趣小组设计实验探究 , 催化空气氧化的效率。回答下列问题:(1)、步骤Ⅰ 制备
(4)、“焙烧”时,主要反应的化学方程式为。(5)、“水浸”后得到的“滤液2”可返回工序循环使用。12. 某兴趣小组设计实验探究 , 催化空气氧化的效率。回答下列问题:(1)、步骤Ⅰ 制备在通风橱中用下图装置制备(加热及夹持装置省略),反应方程式:

装置A中盛放甲酸的仪器的名称是。
(2)、从B、C、D中选择合适的装置收集 , 正确的接口连接顺序为a→→→→→h(每空填一个接口标号)。(3)、步骤Ⅱ 检验将通入新制银氨溶液中,有黑色沉淀生成。
该反应的化学方程式为。(4)、步骤Ⅲ 探究催化空气氧化的效率将一定量与空气混合,得到体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 , 按一定流速通入气体样品。(已知:是白色固体,易吸水潮解:)

通入(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了。
①能证明被空气氧化的现象是;
②被催化氧化的百分率为;
③若未通入氮气,②的结果将(填“偏大”“偏小”或“无影响”)。
(5)、探究气体与催化剂接触时长对催化氧化效率的影响时,采用方法可以缩短接触时长。(6)、步骤Ⅲ装置存在的不足之处是。13. 异丙醇可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯的工业化技术已引起人们的关注,其主要反应如下:Ⅰ.
Ⅱ.
回答下列问题:
(1)、已知 , 则燃烧生成和的热化学方程式为。(2)、在下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:反应时间
0
4
8
12
t
20
浓度
0
2440
3200
3600
4000
4100
①内,;
②t16(填“>”“<”或“=”)。
(3)、在恒温刚性密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是(填标号)。a.的分压不变 b.混合气体密度不变
c. d.
(4)、在一定条件下,若反应Ⅰ、Ⅱ的转化率分别为98%和40%,则丙烯的产率为。(5)、下图为反应Ⅰ、Ⅱ达到平衡时与温度的关系曲线。
(已知:对于可逆反应 , 任意时刻 , 式中)表示物质×的分压)
①在恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的点(填“甲”“乙”或“丙”),判断依据是。
②时,在密闭容器中加入一定量的 , 体系达到平衡后,测得的分压为 , 则水蒸气的分压为(用含x的代数式表示)。
14. 1962年首个稀有气体化合物问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪 (36Kr)次之,氩(18Ar)化合物极少。是与分子形成的加合物,其晶胞如下图所示。
回答下列问题:
(1)、基态原子的价电子排布式为。(2)、原子的活泼性依序增强,原因是。(3)、晶体熔点:(填“>”“<”或“=”),判断依据是。(4)、的中心原子的杂化轨道类型为。(5)、加合物中 , 晶体中的微粒间作用力有(填标号)。a.氢键 b.离子键 c.极性共价键 d.非极性共价键
15. 3-氧代异紫杉二酮是从台湾杉中提取的具有抗痛活性的天然产物。最近科学家完成了该物质的全合成,其关键中间体(F)的合成路线如下: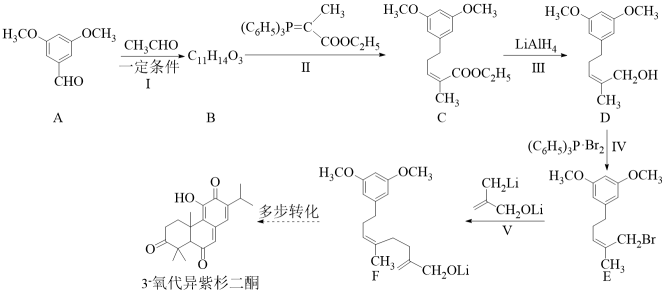
已知:

回答下列问题:
(1)、A的含氧官能团有醛基和。(2)、B的结构简式为。(3)、Ⅳ的反应类型为;由D转化为E不能使用的原因是。(4)、反应Ⅴ的化学方程式为。(5)、化合物Y是A的同分异构体,同时满足下述条件:①Y的核磁共振氢谱有4组峰,峰面积之比为。
②Y在稀硫酸条件下水解,其产物之一(分子式为)遇溶液显紫色。则Y的结构简式为。