天津市河北区2022-2023 学年高三下学期总复习质量检测(一) 化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 化学与生活、科技密切相关。下列说法错误的是( )A、北京冬奥会聚氨酯速滑服属于有机高分子材料 B、我国发射的火星探测器,其太阳能电池板的主要材料是二氧化硅 C、神舟十二号航天员使用的碳纤维材料操纵棒属于无机非金属材料 D、北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素2. 下列表述错误的是( )A、干冰和石英晶体类型不同 B、简单氢化物的沸点: C、、HCN中碳原子的杂化方式相同 D、HCl比易溶于水可用“相似相溶”规律解释3. 下列变化中,未涉及到电子转移的是( )A、使粉末变白 B、使酸性溶液褪色 C、KSCN溶液使含的溶液变红 D、使酸化的KI溶液变黄4. 维生素C的结构简式如图所示。下列说法错误的是( )
 A、维生素C分子中含有键和键 B、维生素C可保存在强碱性环境中 C、维生素C能使溴水、酸性溶液褪色 D、维生素C中所含的官能团是羟基、酯基和碳碳双键5. 常温下,下列指定溶液中,各组离子一定能大量共存的是( )A、的溶液:、、、 B、溶液:、、、 C、甲基橙为黄色的溶液:、、、 D、的溶液:、、、6. 为阿伏加德罗常数,下列叙述中正确的是( )A、常温常压下,与混合气体共含个氧原子 B、标准状况下,22.4L乙烯中含有的键数目为 C、密闭容器中,与充分反应生成HI(g),容器内分子数小于 D、常温下与过量稀NaOH溶液反应,转移的电子总数为7. 下列解释事实的方程式正确的是( )A、的水解平衡: B、稀和铜反应: C、向AgCl浑浊液中滴加溶液,白色沉淀变黑: D、与在酸性条件下混合产生黄色沉淀:8. 有a、b、c、d四种短周期主族元素,它们在周期表中的位置如图所示,已知四种元素中只有b为金属元素,则下列有关说法中正确的是( )
A、维生素C分子中含有键和键 B、维生素C可保存在强碱性环境中 C、维生素C能使溴水、酸性溶液褪色 D、维生素C中所含的官能团是羟基、酯基和碳碳双键5. 常温下,下列指定溶液中,各组离子一定能大量共存的是( )A、的溶液:、、、 B、溶液:、、、 C、甲基橙为黄色的溶液:、、、 D、的溶液:、、、6. 为阿伏加德罗常数,下列叙述中正确的是( )A、常温常压下,与混合气体共含个氧原子 B、标准状况下,22.4L乙烯中含有的键数目为 C、密闭容器中,与充分反应生成HI(g),容器内分子数小于 D、常温下与过量稀NaOH溶液反应,转移的电子总数为7. 下列解释事实的方程式正确的是( )A、的水解平衡: B、稀和铜反应: C、向AgCl浑浊液中滴加溶液,白色沉淀变黑: D、与在酸性条件下混合产生黄色沉淀:8. 有a、b、c、d四种短周期主族元素,它们在周期表中的位置如图所示,已知四种元素中只有b为金属元素,则下列有关说法中正确的是( )a
b
c
d
A、第一电离能:d>c>b B、离子半径:c>d>a C、简单气态氢化物的稳定性:a<c<d D、c的最高价氧化物的水化物为强酸9. 茶叶中铁元素检验可用以下步骤完成,各步选用的实验用品不需要的是( )A
B
C
D




将茶叶灼烧灰化
用浓硝酸溶解茶叶灰并加蒸馏水稀释
过滤得到滤液
检验滤液中的
A、A B、B C、C D、D10. 关于生物体中普遍存在的有机化合物,下列说法正确的是( )A、核糖与葡萄糖互为同分异构体 B、聚丙烯酸钠是通过缩聚反应制得 C、苯胺在酸性下可发生水解反应 D、淀粉可以发生酯化反应和水解反应11. 以下实验设计能达到实验目的的是( )实验目的
实验设计
A
制备无水
加热蒸发与稀盐酸反应后的溶液
B
除去固体中的
将固体充分加热至恒重
C
鉴别NaBr和KI溶液
分别加新制氯水后,用萃取
D
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
A、A B、B C、C D、D12. 室温下,下列说法正确的是( )A、向溶液中加水稀释,溶液中减小 B、等物质的量浓度的和NaF溶液,前者pH较大,则可发生反应: C、的溶液与的溶液,水的电离程度相同 D、等浓度、等体积的NaOH溶液和二元弱酸溶液混合后溶液呈酸性,则混合液中:二、填空题
-
13. 元素周期表中,铍(Be)与铝处于对角线的位置,它们的性质相似。试回答:(1)、Be元素在元素周期表中的位置: , 有关Be性质的推断错误的是(填序号)。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,溶液的
(2)、已知: , 写出与NaOH溶液反应的离子方程式(铍酸根离子为):(3)、基态铝原子的价电子排布式为 , 镁铝合金经过高温淬火获得一种储钠材料,用法测定其晶胞结构如图1所示,图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为 , 该立方晶胞的晶胞的密度为 , 设阿伏加德罗常数的值为 , 则该晶胞中镁铝之间的最近距离为pm。(列出计算式,可不化简)。 (4)、铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: , 电池结构如图2所示。放电时,正极反应式为 , 充电时,应将铝-石墨电极与外接电源的极相连。14. 温度感受器的发现与辣椒素有关。辣椒素I的一种合成路线如下(部分试剂或产物略)。
(4)、铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: , 电池结构如图2所示。放电时,正极反应式为 , 充电时,应将铝-石墨电极与外接电源的极相连。14. 温度感受器的发现与辣椒素有关。辣椒素I的一种合成路线如下(部分试剂或产物略)。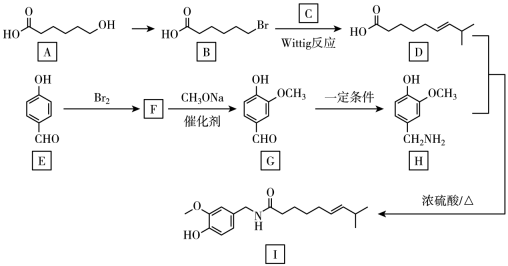
已知: , 请回答下列问题:
(1)、A的分子式为;由A生成B的反应类型为。(2)、D中的官能团名称为;C的结构简式为。(3)、F→G的化学反应方程式为。(4)、G的同分异构体中,同时符合下列条件的有种(不含立体异构)其中核磁共振氢谱为五组峰的同分异构体的结构简式为。①能与溶液发生显色反应;②能与饱和碳酸氢钠溶液反应放出气体。
(5)、利用Wittig反应,设计以溴化苄( )为原料合成
)为原料合成 的路线(无机试剂任选,不考虑产物的立体异构)。 15. 二氧化氯常温下为气体,是一种高效、广谱、安全的杀菌消毒剂。某兴趣小组通过图1装置(夹持装置略)对二氧化氯制备、吸收、释放和应用进行了研究。(已知:装置A中反应生成气体和气体)
的路线(无机试剂任选,不考虑产物的立体异构)。 15. 二氧化氯常温下为气体,是一种高效、广谱、安全的杀菌消毒剂。某兴趣小组通过图1装置(夹持装置略)对二氧化氯制备、吸收、释放和应用进行了研究。(已知:装置A中反应生成气体和气体) (1)、仪器A的名称是。(2)、打开B的活塞,为使在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”)。(3)、关闭B的活塞,在D中被稳定剂完全吸收生成 , 此时F中溶液的颜色不变,则装置C的作用是。(4)、已知在酸性条件下可发生反应生成NaCl并释放出(不考虑其他副反应),在释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 , 安装F中导管时,应选用图2中的(填字母序号)。(5)、已吸收气体的稳定剂I和稳定剂II,加酸后释放的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 , 原因是。
(1)、仪器A的名称是。(2)、打开B的活塞,为使在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”)。(3)、关闭B的活塞,在D中被稳定剂完全吸收生成 , 此时F中溶液的颜色不变,则装置C的作用是。(4)、已知在酸性条件下可发生反应生成NaCl并释放出(不考虑其他副反应),在释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 , 安装F中导管时,应选用图2中的(填字母序号)。(5)、已吸收气体的稳定剂I和稳定剂II,加酸后释放的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 , 原因是。 (6)、自来水厅用碘量法检测水中的浓度,其实验操作如下:取水样,酸化,加入足量的碘化钾,用氢氧化钠溶液调至中性,加入淀粉溶液。再用标准溶液滴定碘单质()。达到滴定终点时现象为。16. 汽车尾气含有CO2、CO、H2O、氮氧化合物(用N2O表示)等气体,CO和N2O为大气污染物。回答下列问题:(1)、CO2分子的VSEPR模型为。(2)、用CO还原N2O的能量变化如下图所示:
(6)、自来水厅用碘量法检测水中的浓度,其实验操作如下:取水样,酸化,加入足量的碘化钾,用氢氧化钠溶液调至中性,加入淀粉溶液。再用标准溶液滴定碘单质()。达到滴定终点时现象为。16. 汽车尾气含有CO2、CO、H2O、氮氧化合物(用N2O表示)等气体,CO和N2O为大气污染物。回答下列问题:(1)、CO2分子的VSEPR模型为。(2)、用CO还原N2O的能量变化如下图所示:
则反应 △H=kJ/mol
(3)、在相同温度和压强下,1 mol N2O和1 mol CO经过相同反应时间(均未达平衡)测得,反应物转化率使用催化剂1催化剂2(填“大于”、“等于”、“小于”)。(4)、在体积均为1 L的密闭容器A(500℃,恒温),B(起始500℃,绝热)两个容器中分别加入0.1 mol N2O、0.4 mol CO和相同催化剂,实验测得A、B容器中N2O的转化率随时间的变化关系如图所示。
①B容器中N2O的转化率随时间的变化关系是上图中的曲线(填“a”或“b”)。
②在密闭容器A中,下列事实能判断反应达到平衡状态的是。
A.气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.体系中CO的转化率不变 D.比值不再变化
③要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是。
④500℃该反应的化学平衡常数K=(用分数表示)。