四川省宜宾市2023届高三下学期第二次诊断考试理科综合化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 传统酿酒过程的部分操作如图所示。下列说法错误的是( )




蒸粮
拌曲
堆酵
馏酒
A、“蒸粮” 时适当鼓风可加快燃烧速率 B、“拌曲”时加入的酒曲起催化作用 C、“堆酵” 过程中淀粉会发生水解 D、“馏酒”得到的馏出物为纯净物2. 利用电催化实现CO2到C2H5OH的转化,反应原理:6H2+2CO2C2H5OH+3H2O。设NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、11.2L CO2中含分子的数目为0.5 NA B、23gC2H5OH中含共价键的数目为4 NA C、生成1 mol C2H5OH转移电子的数目为8 NA D、4gH2与4gD2所含中子的数目相差NA3. 短周期主族元素X、Y、Z、W在周期表中的位置如图所示,其中X、W最低负化合价之和为-4,下列说法错误的是( )Y
Z
X
W
A、原子半径: X>Y B、单质的熔点: X> W C、X与W只能形成一种化合物 D、简单氢化物的稳定性: Z> W4. 能正确表示下列反应的离子方程式是( )A、向饱和Na2CO3溶液中通入足量CO2: B、铜丝插入浓硫酸中: 2H+ +Cu=Cu2++H2↑ C、Cl2通入水中: Cl2+H2O 2H+ +Cl- +ClO- D、向AlCl3溶液中滴加过量NaOH溶液: Al3++3OH-=Al(OH)3↓5. 布洛芬具有抗炎、镇痛、解热作用,其成酯修饰反应(如下图)得到的产物疗效更佳。下列说法错误的是( ) A、上述反应为取代反应 B、布洛芬的分子式为C13H18O2 C、布洛芬与苯甲酸(
A、上述反应为取代反应 B、布洛芬的分子式为C13H18O2 C、布洛芬与苯甲酸( )互为同系物
D、布洛芬的成酯修饰产物分子中最多只有8个碳原子共平面。
6. 由乙烯制备2-氯乙醇(HOCH2CH2Cl)的原理为:CH2=CH2+HClO→HOCH2CH2Cl。用铂(Pt)作电极电解KCl溶液制备2-氯乙醇的装置如下图所示。下列说法错误的是( )
)互为同系物
D、布洛芬的成酯修饰产物分子中最多只有8个碳原子共平面。
6. 由乙烯制备2-氯乙醇(HOCH2CH2Cl)的原理为:CH2=CH2+HClO→HOCH2CH2Cl。用铂(Pt)作电极电解KCl溶液制备2-氯乙醇的装置如下图所示。下列说法错误的是( ) A、Y连接电源的负极 B、电解时,K+通过阳离子交换膜从左侧移向右侧 C、理论上,制取1 mol 2-氯乙醇生成气体b的体积为11.2L (标准状况) 。 D、电解时,左侧溶液pH逐渐减小,右侧溶液pH逐渐增大7. 下列实验操作、现象及结论均正确的是( )
A、Y连接电源的负极 B、电解时,K+通过阳离子交换膜从左侧移向右侧 C、理论上,制取1 mol 2-氯乙醇生成气体b的体积为11.2L (标准状况) 。 D、电解时,左侧溶液pH逐渐减小,右侧溶液pH逐渐增大7. 下列实验操作、现象及结论均正确的是( )选项
操作
现象
结论
A
向菠菜汁中加入少量稀硝酸,再滴入几滴KSCN溶液
溶液变红
菠菜汁中含有Fe3+
B
将在酒精灯上灼烧后的铜丝迅速插入乙醇中
铜丝表面由黑色变为红色
乙醇具有还原性
C
相同温度下,用pH计分别测定0.010 mol/LHF溶液和0.010 mol/L CH3COOH溶液的pH
HF溶液pH更小
Ka(HF)<Ka(CH3COOH)
D
向0.01 mol/L FeCl3溶液中,加入少量FeCl3固体
溶液颜色加深
Fe3+水解程度增大
A、A B、B C、C D、D二、非选择题
-
8. 过碳酸钠(2Na2CO3·3H2O2)是一种易溶于水,易分解的强氧化剂。它的一种“常温结晶”制备方法的原理为:2Na2CO3(s)+3H2O2(1)=2Na2CO3·3H2O2(s) ΔH<0,实验装置如图所示(夹持装置略去)。

已知:通常以活性氧质量分数[ω(活性氧)=]来衡量过碳酸钠产品的优劣。
实验步骤:
ⅰ. 称取一定量无水碳酸钠,置于烧杯中,加蒸馏水溶解,将溶液转移到三颈烧瓶内,加入稳定剂,搅拌混匀。
ⅱ. 控制温度为25℃,边搅拌边向三颈烧瓶中缓慢滴加30%的H2O2溶液。
ⅲ. 再向三颈烧瓶中加入一定量的无水乙醇,反应一段时间。
ⅳ. 静置、真空抽滤、干燥得粗产品,冷却称重。
回答下列问题:
(1)、仪器a的名称为。(2)、实验过程中产生的气体副产物是 ( 填化学式),装置中玻璃导管的作用是。(3)、步骤ii中,可采取的控温措施是。滴加H2O2溶液速度不能太快,原因是(4)、步骤iii中,加入乙醇的目的是。反应时间与产率、活性氧质量分数(ω)的关系如下图所示,最适宜的反应时间为min左右。 (5)、现将0.50g粗产品(杂质不参与反应)置于锥形瓶中,加水溶解,再加入足量稀H2SO4 , 用0.1000 mol/LKMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。则粗产品中活性氧质量分数是。9. 废旧磷酸铁锂电池的正极材料中含有LiFePO4、Al、导电剂(乙炔墨、碳纳米管)等。工业上利用废旧磷酸铁锂电池的正极材料制备Li2CO3的工艺流程如下:
(5)、现将0.50g粗产品(杂质不参与反应)置于锥形瓶中,加水溶解,再加入足量稀H2SO4 , 用0.1000 mol/LKMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。则粗产品中活性氧质量分数是。9. 废旧磷酸铁锂电池的正极材料中含有LiFePO4、Al、导电剂(乙炔墨、碳纳米管)等。工业上利用废旧磷酸铁锂电池的正极材料制备Li2CO3的工艺流程如下:
已知:①LiFePO4不溶于碱,可溶于稀酸。
②常温下,Ksp(FePO4)=1.3×10-22 , Ksp[Fe(OH)3]=4.0 × 10-38。
③Li2CO3在水中溶解度:
温度/℃
0
20
40
60
80
100
溶解度/g
1.54
1.33
1.17
1.01
0.85
0.72
回答下列问题:
(1)、将电池粉粹前应先放电,放电的目的是。(2)、“滤液A”中的溶质主要是。(3)、“酸浸”时,加入H2O2溶液的目的是(用离子方程式表示)。盐酸用量不宜太多,结合后续操作分析,原因是。。(4)、“沉铁沉磷”时,当溶液pH从1.0增大到2.5时,沉铁沉磷率会逐渐增大,但pH超过2.5以后,沉磷率又逐渐减小。从平衡移动的角度解释沉磷率减小的原因是。(5)、“提纯”时,可用热水洗涤Li2CO3粗品,理由是。(6)、制取的Li2CO3、FePO4与足量的炭黑混合,隔绝空气高温灼烧得到LiFePO4 , 反应的化学方程式是。10. 将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:(1)、已知:①2H2(g)+O2(g) =2H2O(g) ΔH= − 484 kJ∙mol−1②2CH3OH(g)+ 3O2(g) =2CO2(g)+4H2O(g) ΔH =−1353 kJ∙mol−1
则CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) ΔH = kJ∙mol−1。
(2)、在恒压密闭容器中通入CO2和H2的混合气体,制备甲醇过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:T/℃
170
180
1 90
200
210
220
230
STY/[mol/(mol·h)]
0.10
0.15
0.20
0.25
0.28
0.20
0.15
①该反应最适宜的温度是。
②在220℃和170 ℃条件下,该反应速率之比: υ(220℃): υ(170℃)=。
③随温度升高,甲醇的时空收率先增大后减小,可能的原因是。
(3)、CO2催化加氢制甲醇过程中,存在竞争的副反应主要是: CO2(g)+H2(g) CO(g)+H2O(g) ΔH =+41 kJ∙mol−1。在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[(CH3OH)%= ×100%]随着温度变化关系如下图所示。
①分析温度高于236℃时图中曲线下降的原因。
②按1 mol CO2(g)、3 mol H2(g)投料反应,计算 244℃时反应生成CH3OH的物质的量为mol。 (保留两位有效数字)
③在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数Kp=。 ( 列出计算式即可)
11. 铁及其化合物在生活、生产中有重要应用。回答下列问题:(1)、乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。①Fe2+的价层电子排布式是。
②乳酸分子(
 )中 σ 键与π键的数目比为。
)中 σ 键与π键的数目比为。③乳酸亚铁中各元素的电负性由大到小的顺序为。
④C与O中,第一电离能较大的是 , O的第二电离能远大于第一电离能的原因是。
(2)、无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。①[Fe(NH3)6]Cl2中Fe2+的配位数为。
②NH3的空间构型是 , 其中N原子的杂化方式是。
(3)、由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。
①该超导材料的化学式是。
②该晶胞参数a=0.4 nm、c=1.4 nm,该晶体密度ρ=g·cm-3。(用 NA表示阿伏加德罗常数,写出计算表达式即可)
③该晶胞在xy平面投影如图2所示,将图2补充完整。
 12. 甜味剂指用于替代糖增加食品甜度的物质。合成甜味剂阿斯巴甜的某种合成路线如下图所示:
12. 甜味剂指用于替代糖增加食品甜度的物质。合成甜味剂阿斯巴甜的某种合成路线如下图所示: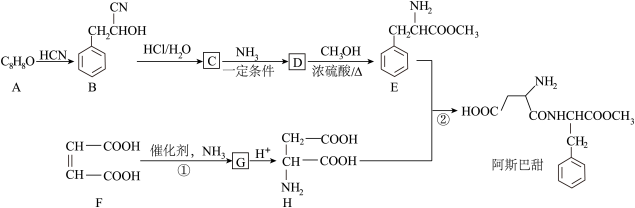
已知:醛或酮可以发生如下反应:

回答下列问题:
(1)、A的化学名称是。(2)、C中所含官能团的名称为。C→D的反应类型为。(3)、D的结构简式为。(4)、反应①的化学方程式为。(5)、反应②为成肽反应,除生成阿斯巴甜外,E与H还可能生成的二肽产物为。(6)、E的同分异构体有多种,写出一种能同时满足下列条件的结构简式:。①分子中含有硝基。
②苯环上有三个取代基
③核磁共振氢谱有四组峰且峰面积比为1:2:4:6
(7)、参照上述合成路线,以1-丙醇为起始原料(其他试剂任选),设计制备化合物 的合成路线。
的合成路线。