四川省成都市2023届高三下学期二模理综化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 化学与生活、生产密切相关。下列说法错误的是( )A、用生石灰脱燃煤中的硫,最终硫可转变为CaSO4 B、用作信息高速公路的石英光导纤维是一种新型有机高分子材料 C、净水池中加入活性炭有吸附色素和除异味的作用 D、作反应容器涂层的聚四氟乙烯能抗酸、碱,耐腐蚀2. 设NA表示阿伏加德罗常数值,下列叙述一定正确的是( )A、28g14CO中含有中子数为14NA B、1mol O2与一定量甲烷反应转移电子数目为4NA C、1L浓度为0.1 mol∙L−1Na2CO3溶液中阴离子数目为0.1NA D、28g C2H4和C3H6混合物中含有共用电子对数目6NA3. 具有美白功效的某化妆品主要成分Z的合成如图:

下列分析错误的是( )
A、1molX最多与4molH2发生加成反应 B、Y中所有原子可能共面 C、X和Y反应生成Z为加成反应 D、Z中苯环上一氯代物有8种4. 主族元素X、Y、Z、W分别位于三个短周期,且原子序数依次增大。X、Y可形成化合物A的结构式为:X-Y-Y-X;Y、Z、W可形成具有强氧化性的化合物B,其电子式为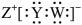 。下列说法错误的是( ) A、原子半径:Z>Y>X B、W的最高价氧化物的水化物为强酸 C、B的浓溶液可用pH试纸测其酸碱性 D、化合物A、B都可用作新型冠状病毒的消毒剂5. 由下列实验和现象推出的结论错误的是( )
。下列说法错误的是( ) A、原子半径:Z>Y>X B、W的最高价氧化物的水化物为强酸 C、B的浓溶液可用pH试纸测其酸碱性 D、化合物A、B都可用作新型冠状病毒的消毒剂5. 由下列实验和现象推出的结论错误的是( )选项
实验和现象
结论
A
向X溶液中滴入稀HNO3酸化的AgNO3溶液,产生白色沉淀
溶液中一定含Cl-”或或两者均有
B
向油脂中加烧碱溶液,加热一段时间,将混合液倒入盛水烧杯中,水面上无油滴与油膜
油脂完全皂化
C
向含KIO3的食盐溶液中滴加淀粉和KI溶液,滴入稀硫酸,溶液变蓝
氧化性:酸性条件下>I2
D
向5mL0.1 mol∙L−1KI溶液中加入0.1 mol∙L−1FeCl3溶液1mL,振荡,取反应后的溶液滴入3滴KSCN溶液,溶液变红色
Fe3+和I-反应为可逆反应
A、A B、B C、C D、D6. 某化学小组构想用电化学原理回收空气中二氧化硫中的硫,同时将地下水中的硝酸根(NO)进行无害化处理,其原理如图。
下列有关说法错误的是( )
A、Mg电极为负极,Pt1为阳极 B、乙池中NO在Pt1 , 电极发生还原反应 C、碳纳米管析出硫的电极反应为:SO2+4e-=S+2O2- D、Pt2电极可能产生H2 , 周围pH增大7. 向某Na2A、NaHA的混合液中加入CaCl2固体(忽略溶液体积、温度的变化),测出溶液中离子浓度变化如图所示。已知:Ksp(CaA)=2×10−9 , H2A为二元弱酸,Ca(HA)2易溶于水且溶液呈碱性。下列说法正确的是( ) A、X、Y、Z三点对应溶液pH大小顺序为:X<Y<Z B、X点溶液中可能存在:c(OH-)=c(H+) C、Y点溶液中c(HA-)=2×10−2 mol∙L−1 D、向Z点溶液中通入HCl气体,可以使Z点溶液向Y点溶液转化
A、X、Y、Z三点对应溶液pH大小顺序为:X<Y<Z B、X点溶液中可能存在:c(OH-)=c(H+) C、Y点溶液中c(HA-)=2×10−2 mol∙L−1 D、向Z点溶液中通入HCl气体,可以使Z点溶液向Y点溶液转化二、非选择题
-
8. 某化学小组制取无水三氯化铁并研究其与铜的反应,设计如图实验。(1)、I.制备无水三氯化铁实验装置如图。(已知无水三氯化铁易潮解,易升华)

试剂X可以是;若缺少C装置其后果是(写一条)。
(2)、整个装置充满黄绿色气体后,才开始加热D装置的目的是。(3)、若实验过程中FeCl3沉积在D和E的导管之间,导致导管内径变小,除去沉积FeCl3的简易操作是。(4)、II.探究三氯化铁与铜反应的实验如图:(已知CuCl、CuSCN是难溶于水的白色固体)

请从平衡角度说明红色褪去的可能原因。
(5)、为了进一步研究白色沉淀进行如图实验。
①如图蓝色溶液中可能含有的盐有Cu(NO3)2、。
②实验中CuSCN与过量稀HNO3反应生成白色沉淀B的阴离子,同时生成N2、NO和CO2气体。CuSCN与HNO3反应中还原剂与氧化剂的物质的量之比为(已知SCN-中C为+4价)。
9. 硫酸镁可用于印染、造纸、医药工业。利用某水泥厂的废料(含50%MgO,还有少量CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质),制取MgSO4∙7H2O的流程如图:
回答下列问题
(1)、“酸浸”时,pH控制为1,若提高浸取速率,可采取的措施是(任写一条)。(2)、“氧化”时,NaClO与Mn2+按物质的量1:1反应生成MnO2 , 其离子方程式为;调节pH时可加入试剂X为(任写一种)。(3)、滤渣除Al(OH)3、Fe(OH)3外还有氧化物。(4)、“除钙”时,控温在60℃时除去MgSO4和CaSO4混合溶液中的CaSO4。①参照表格,简要说明除钙的操作方法。
②60℃下CaSO4的Ksp=。(饱和CaSO4溶液的密度约为1.0g∙L−1)
部分物质的溶解度(g/100gH2O)如表:
温度/℃
物质
20
40
60
80
MgSO4
28.6
30.9
36
40.8
CaSO4
0.272
0.23
0.204
0.184
(5)、为了提高原料中镁的利用率,操作a后滤液的处理方法是。10. 汽车尾气的氮氧化物是大气污染物的主要来源,研究汽车尾气处理是环境保护的重要课题。试回答下列问题:(1)、有关汽车尾气的生成已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则3NO(g)=N2O(g)+NO2(g) ΔH=。
(2)、用CO消除汽车尾气在催化剂a作用下将尾气转化为无污染的气体而除去。向密闭容器中充入10molCO(g)和8molNO(g)发生反应2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。

①已知T2>T1 , 则反应ΔH0(填“>”、“=”或“<”)。
②该反应达到平衡后,为了同时提高反应速率和NO的平衡转化率,可采取的措施(填字母序号)。
a.改用高效催化剂
b.恒温恒容条件下,按投料比增大反应物浓度
c.移去CO2
d.升高温度
e.缩小反应容器的体积
③在温度为T1、容器体积为4L的条件下,反应进行到10min时恰好在D点达到平衡。则从反应开始到平衡时,NO平均反应速率v(NO)=;若其他条件不变,升高温度,用分压表示的平衡常数Kp(填“变大”、“变小”或“不变”)。
④在X点,对反应容器升温的同时扩大体积使体系压强减小,重新达到平衡状态可能为图中点(填A~F)。
(3)、用NH3消除汽车尾气新型催化剂b在含有少量O2条件下,能催化NH3 , 和NOx , 反应生成N2 , 且高温下活性很强。在盛有催化剂b的管式反应容器[如图(一)]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图(二)所示。

①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是。
②当温度高于300℃时,NOx除去率迅速下降的原因是。
11. 硒是人体需要的重要微量元素之一,参与体内多种代谢。试回答下列问题:(1)、硒元素的基态原子核外电子排布中成对电子与成单电子的个数比为;在同一周期中比它的第一电离能大的元素有种。(2)、SeO3与水反应可以生成H2SeO4。H2SeO4分子中心原子的轨道杂化方式为;固体H2SeO4 , 存在作用力除范德华力共价键外还有;从分子结构的角度解释H2SeO4比H3AsO4酸性强的原因是。(3)、固态SeO2(如图)是以锥体形的角氧相连接的聚合结构,每一个锥体带一个端氧原子。
①同为分子晶体,SeO2 , 熔点为350℃而SO2的熔点为-75.5℃,原因是。
②图中Se-O键较短的是(填“a”或”b”)。
(4)、在一定条件下MgSe晶体结构为NaCl型(如图),Se2-为面心立方最密堆积方式,经测定MgSe的晶胞参数为anm,则Se2-的半径r(Se2-)为nm(写出表达式);CaSe晶体结构也为NaCl型,其晶胞参数比MgSe大,且r(Ca2+)=bnm,则CaSe晶体的密度为g•cm-3(写出表达式)。 12. 某有机药物中间体J的合成路线(部分反应条件略去)如图:
12. 某有机药物中间体J的合成路线(部分反应条件略去)如图:
已知:ROH
 +CH3COOH
+CH3COOH试回答下列问题:
(1)、B的化学名称为;反应①的试剂和条件为。(2)、反应③可以看作发生了两步反应,首先C与丙酮发生反应(填反应类型),再发生消去反应得到D。(3)、F的结构简式为;G的含氧官能团的名称是。(4)、反应⑦的化学方程式为。(5)、G的同分异构体中,能发生水解反应且分子中含有苯环的有种,其中核磁共振氢谱有5组吸收峰的结构简式为。