上海市徐汇区2022-2023学年高三下学期4月学习能力诊断化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 12C和14C互为( )A、同分异构体 B、同位素 C、同系物 D、同素异形体2. 下列变化中,属于物理变化的是( )A、氯气液化 B、石油裂化 C、金属钝化 D、蔗糖炭化3. 金属是现代工业非常重要的材料。下列说法错误的是( )A、Al的表面易形成致密的氧化膜 B、生铁含碳量高,熔点比纯铁低 C、钢铁在潮湿的空气中生锈,主要发生化学腐蚀 D、铝热反应可以用来冶炼某些难熔的金属4. 下列物质不能通过化合反应直接转化的是( )A、 B、 C、 D、5. 下列物质沸点的比较,正确的是( )A、<
 B、
C、
D、
6. 可用于检验溶液是否少量变质的试剂( )A、NaOH B、Fe C、 D、KSCN7. 使用石墨电极电解溶液,阴极产物为( )A、 B、Cu C、 D、8. 利用反应可制备。下列说法正确的是( )A、是还原产物 B、是弱电解质 C、的结构式为 D、NaClO和NaCl所含的化学键类型完全相同9. 实验室用98%的浓硫酸配制的稀硫酸。下列说法错误的是( )A、应选用200mL容量瓶 B、可选用量筒量取浓硫酸 C、在烧杯中稀释浓硫酸 D、定容时应选用胶头滴管10. 75%乙醇、含氯消毒剂都能有效灭活病毒。下列说法正确的是( )A、乙醇能与水以任意比例互溶 B、乙醇浓度越高灭活效果越好 C、漂粉精的主要成分是NaClO D、都是利用氧化性灭活病毒11. 有关工业合成氨的说法错误的是( )A、不断移去液氨,有利于反应正向进行 B、400~500℃时,原料的平衡转化率最大 C、增大压强,氨的分解速率增加 D、原料气须经过净化处理,以防止催化剂中毒12. 氮化硅是一种性能优异的半导体材料。下列说法正确的是( )A、硅也是一种半导体材料 B、非金属性: C、原子半径: D、硅位于第3周期第VIA族13. 在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )A、中和时所需NaOH的量 B、溶液的导电能力 C、H+的物质的量 D、CH3COOH的物质的量14. 分子构型可能为平面型的是( )A、 B、 C、 D、
B、
C、
D、
6. 可用于检验溶液是否少量变质的试剂( )A、NaOH B、Fe C、 D、KSCN7. 使用石墨电极电解溶液,阴极产物为( )A、 B、Cu C、 D、8. 利用反应可制备。下列说法正确的是( )A、是还原产物 B、是弱电解质 C、的结构式为 D、NaClO和NaCl所含的化学键类型完全相同9. 实验室用98%的浓硫酸配制的稀硫酸。下列说法错误的是( )A、应选用200mL容量瓶 B、可选用量筒量取浓硫酸 C、在烧杯中稀释浓硫酸 D、定容时应选用胶头滴管10. 75%乙醇、含氯消毒剂都能有效灭活病毒。下列说法正确的是( )A、乙醇能与水以任意比例互溶 B、乙醇浓度越高灭活效果越好 C、漂粉精的主要成分是NaClO D、都是利用氧化性灭活病毒11. 有关工业合成氨的说法错误的是( )A、不断移去液氨,有利于反应正向进行 B、400~500℃时,原料的平衡转化率最大 C、增大压强,氨的分解速率增加 D、原料气须经过净化处理,以防止催化剂中毒12. 氮化硅是一种性能优异的半导体材料。下列说法正确的是( )A、硅也是一种半导体材料 B、非金属性: C、原子半径: D、硅位于第3周期第VIA族13. 在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )A、中和时所需NaOH的量 B、溶液的导电能力 C、H+的物质的量 D、CH3COOH的物质的量14. 分子构型可能为平面型的是( )A、 B、 C、 D、 15. 用下列实验装置进行相应实验,能达到实验目的的是( )
15. 用下列实验装置进行相应实验,能达到实验目的的是( )A
B
C
D
装置
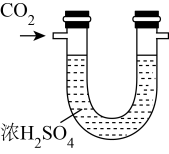



目的
干燥CO2
提纯乙酸乙酯
发生铝热反应
制取Cl2
A、A B、B C、C D、D16. 实验室用苯与溴反应制备溴苯,关于说法正确的是( )A、可以用溴水代替液溴,减少溴的挥发 B、将生成气体直接通入溶液,检验反应是否生成HBr C、铁粉作催化剂,苯与溴既能发生加成反应,也能发生取代反应 D、反应后的混合液经稀碱溶液洗涤、分液、蒸馏,即可得到溴苯17. 室温时,下列各组离子在水溶液中可以大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、18. 有关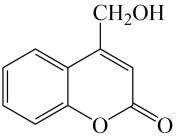 的说法正确的是( ) A、可以与发生加成反应 B、能使溴水褪色 C、只含2种官能团 D、在加热条件下,能与NaOH的乙醇溶液发生消去反应19. 密闭容器中加入HBr,一定条件下发生反应: , 随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法正确的是( )
的说法正确的是( ) A、可以与发生加成反应 B、能使溴水褪色 C、只含2种官能团 D、在加热条件下,能与NaOH的乙醇溶液发生消去反应19. 密闭容器中加入HBr,一定条件下发生反应: , 随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法正确的是( ) A、该反应正反应为放热反应 B、曲线①,0~50min用表示的平均反应速率为 C、曲线②,可能使用了催化剂或压缩容器体积 D、曲线③,达到平衡后,容器内各物质的浓度分别增加 , 平衡正向移动20. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:
A、该反应正反应为放热反应 B、曲线①,0~50min用表示的平均反应速率为 C、曲线②,可能使用了催化剂或压缩容器体积 D、曲线③,达到平衡后,容器内各物质的浓度分别增加 , 平衡正向移动20. 氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:①
②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与投入量(用x表示)的关系如下图所示。下列说法正确的是( )
 A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,
A、的数值为0.009 B、时, C、时,x越大,生成的量越少 D、时,二、填空题
-
21. 金属钠及其化合物在人类生产、生活中起着重要作用。(1)、Na的轨道表示式为。(2)、NaCl的熔点为800.8℃。工业上,采用电解熔融的NaCl和混合盐,制备金属Na,电解的化学方程式为: , 加入的目的是。(3)、采用空气和Na为原料可直接制备。空气与熔融的金属Na反应前需依次通过的试剂为、(填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液
(4)、的电子式为。在25℃和101kPa时,Na与反应生成放出510.9kJ的热量,写出该反应的热化学方程式:。
(5)、向酸性溶液中加入粉末,观察到溶液褪色,发生如下反应。配平上述离子方程式。
该反应说明具有(选填“氧化性”“还原性”或“漂白性”)。
(6)、在密闭容器中,将和bmol固体混合物加热至250℃,充分反应后,若剩余固体为和NaOH、排出气体为和时,的取值范围为。22. 化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术。图1是基于载氧体的甲烷化学链燃烧技术的示意图。
空气反应器与燃料反应器中发生的发应分别为:
①
②
(1)、的颜色为。(2)、反应②的平衡常数表达式。(3)、氧的质量分数:载氧体I载氧体Ⅱ(填“>”“=”或“<”)。往盛有载氧体的刚性密闭容器中充入空气[氧气的物质的量分数为21%],发生反应①。平衡时随反应温度T变化曲线如图2所示。
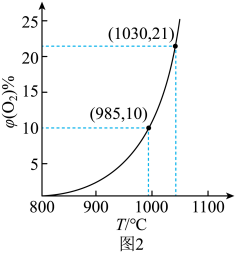 (4)、985℃时,的平衡转化率=(保留两位小数)。(5)、根据图2数据,随温度升高而增大的原因是。反应温度必须控制在1030℃以下,原因是。
(4)、985℃时,的平衡转化率=(保留两位小数)。(5)、根据图2数据,随温度升高而增大的原因是。反应温度必须控制在1030℃以下,原因是。载氧体掺杂改性,可加快化学链燃烧速率。使用不同掺杂的载氧体,反应②的反应历程如图3。
 (6)、由图3分析:使用(填“氧化铝”或“膨润土”) 掺杂的载氧体反应较快。(7)、与传统燃烧方式相比,化学链燃烧技术的优点有。23. 对氨基苯甲酸(
(6)、由图3分析:使用(填“氧化铝”或“膨润土”) 掺杂的载氧体反应较快。(7)、与传统燃烧方式相比,化学链燃烧技术的优点有。23. 对氨基苯甲酸( )主要用作医药、染料中间体。以下是它的一种合成路线(部分试剂和条件省略,不考虑立体异构)。
)主要用作医药、染料中间体。以下是它的一种合成路线(部分试剂和条件省略,不考虑立体异构)。

已知:
(1)、反应①所需的试剂和条件。(2)、反应②的反应类型为。(3)、写出一种检验反应③是否发生的方法。(4)、写出反应⑥的化学方程式。(5)、流程设计反应⑤的目的是。(6)、写出一种满足下列条件,对氨基苯甲酸同分异构体的结构简式。①属于芳香族化合物;②有3种不同化学环境的H原子
(7)、结合相关信息,设计以邻二甲苯和C物质为原料,合成 的合成路线。(无机试剂任选)(合成路线可表示为:目标产物) 24. 现代农业要精准施肥,科学种植。以下是一种实验室测定土壤中含氮量的方法。(1)、(一)提取土壤中的氮
的合成路线。(无机试剂任选)(合成路线可表示为:目标产物) 24. 现代农业要精准施肥,科学种植。以下是一种实验室测定土壤中含氮量的方法。(1)、(一)提取土壤中的氮称取100g土壤于烧杯中,加入足量浓硫酸和一定量的催化剂,充分反应后过滤、洗涤滤渣,往滤液加入足量NaOH溶液,按如图进行蒸馏,用过量硼酸吸收生成的氨。

已知:常温下,
土壤中的氮元素主要存在形式。(填微粒符号)
(2)、向土壤中加入浓硫酸和一定量催化剂的目的。(3)、判断滤渣已洗涤干净的方法为。(4)、丙装置的缺点为。(5)、当丙中尾接管无明显液滴后,需升高温度继续蒸出水蒸气一段时间,目的为。(6)、(二)滴定测量含氮量将锥形瓶内溶液稀释至250mL,取出25.00mL稀释液,向其中滴加2~3滴甲基红(变色范围4.4~6.2),用盐酸标准溶液滴定。重复实验3次,平均消耗盐酸标准溶液18.00mL。
滴定时,发生反应的离子方程式为。
(7)、该土壤样品的含氮量为(以N元素计算)。