辽宁省鞍山市普通高中2023届高三第二次质量监测(二模)化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 下列化学物质的用途及对应性质,说法正确的是( )A、使用来减轻盐碱地(含)的碱性,是利用显酸性 B、葡萄酒添加杀菌,是利用的漂白性 C、果汁中添加维生素C(又称抗坏血酸)防变质,是利用维生素C的酸性 D、铁表面镀锌防腐蚀,是利用活泼的作牺牲阳极2. 设为阿伏加德罗常数的值,下列说法正确的是( )A、质量分数为46%的乙醇溶液中,含键的数目为 B、晶体含有离子总数为 C、含的浓硫酸与足量的镁反应,转移的电子数为 D、常温下,的溶液中,的数目为3. 下列化学用语正确的是( )A、中子数为18的氯原子,符号为: B、反-2-丁烯的键线式:
 C、的空间结构模型:
C、的空间结构模型: D、甲基的电子式:
D、甲基的电子式: 4. 广东名酒“玉冰烧”始载于宋代赵珣的《熙宁酒课》,其独特的风味在于从醪液中得到浓度更高的初酒后,浸入猪膘肉“陈肉酝浸”而成。下图为“玉冰烧”的简要酿造流程,其中说法错误的是( )
4. 广东名酒“玉冰烧”始载于宋代赵珣的《熙宁酒课》,其独特的风味在于从醪液中得到浓度更高的初酒后,浸入猪膘肉“陈肉酝浸”而成。下图为“玉冰烧”的简要酿造流程,其中说法错误的是( ) A、糖化过程中,淀粉是分步水解为单糖的 B、酒化过程的反应原理为: C、操作1为过滤 D、猪膘肉中溶出的酯类化合物可使酒的香气、口感更丰富5. 已知冰醋酸能与氯气在碘催化下发生反应:。对实验过程进行监测,发现过程中出现了键,下列有关说法错误的是( )A、实验中键的产生,可通过红外光谱结果证明 B、键比键更易形成,且键能更大 C、中存在键 D、的酸性比强6. 化合物Z是药物合成的重要中间体,其合成路线如下。下列有关X、Y、Z的说法错误的是( )
A、糖化过程中,淀粉是分步水解为单糖的 B、酒化过程的反应原理为: C、操作1为过滤 D、猪膘肉中溶出的酯类化合物可使酒的香气、口感更丰富5. 已知冰醋酸能与氯气在碘催化下发生反应:。对实验过程进行监测,发现过程中出现了键,下列有关说法错误的是( )A、实验中键的产生,可通过红外光谱结果证明 B、键比键更易形成,且键能更大 C、中存在键 D、的酸性比强6. 化合物Z是药物合成的重要中间体,其合成路线如下。下列有关X、Y、Z的说法错误的是( )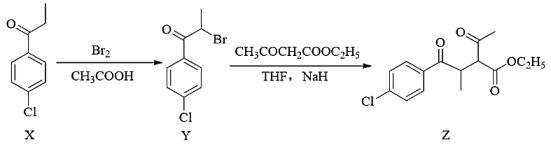 A、X→Y、Y→Z都是取代反应 B、X、Y均能与发生加成反应,且等物质的量的X、Y消耗的氢气相等 C、Y中除氢原子外,其余原子均可处于同一平面上 D、与足量溶液反应最多消耗7. 已知X、Y、Z、W是短周期元素。X元素原子的能级处于半充满状态;Y元素原子L电子层上s电子数和p电子数相等;Z元素的价阳离子的核外电子排布与氖原子相同;W元素原子的M电子层有1个未成对的p电子。下列说法正确的是( )A、含有Y元素的化合物一定是共价化合物 B、电负性:Y>X C、Z元素的第一电离能大于同周期其他元素 D、若W为金属元素,则其单质能与溶液反应放出氢气8. 铝电解厂烟气净化的一种简单流程如下,下列说法正确的是( )
A、X→Y、Y→Z都是取代反应 B、X、Y均能与发生加成反应,且等物质的量的X、Y消耗的氢气相等 C、Y中除氢原子外,其余原子均可处于同一平面上 D、与足量溶液反应最多消耗7. 已知X、Y、Z、W是短周期元素。X元素原子的能级处于半充满状态;Y元素原子L电子层上s电子数和p电子数相等;Z元素的价阳离子的核外电子排布与氖原子相同;W元素原子的M电子层有1个未成对的p电子。下列说法正确的是( )A、含有Y元素的化合物一定是共价化合物 B、电负性:Y>X C、Z元素的第一电离能大于同周期其他元素 D、若W为金属元素,则其单质能与溶液反应放出氢气8. 铝电解厂烟气净化的一种简单流程如下,下列说法正确的是( ) A、可用陶瓷等硅酸盐产品作吸收塔内衬材料 B、采用溶液喷淋法可提高吸收塔内烟气吸收效率 C、合成槽中会随着合成的进行而不断减小 D、冰晶石可作为电解熔融氯化铝制铝时的助熔剂9. 普鲁士蓝是一种辐射应急药物。最初,狄斯巴赫把草木灰和牛血混在一起,制成亚铁氰化钾(其三水合物俗称黄血盐),之后与反应获得了普鲁士蓝。如图是普鲁士蓝晶体的单元结构,下列说法正确的是( )
A、可用陶瓷等硅酸盐产品作吸收塔内衬材料 B、采用溶液喷淋法可提高吸收塔内烟气吸收效率 C、合成槽中会随着合成的进行而不断减小 D、冰晶石可作为电解熔融氯化铝制铝时的助熔剂9. 普鲁士蓝是一种辐射应急药物。最初,狄斯巴赫把草木灰和牛血混在一起,制成亚铁氰化钾(其三水合物俗称黄血盐),之后与反应获得了普鲁士蓝。如图是普鲁士蓝晶体的单元结构,下列说法正确的是( ) A、黄血盐的化学式为 B、在制备黄血盐时,牛血的作用是仅提供元素 C、普鲁士蓝中与的配位数均为6 D、普鲁士蓝的每个晶胞中实际含有3个10. 下列实验方案设计、现象和结论都正确的是( )
A、黄血盐的化学式为 B、在制备黄血盐时,牛血的作用是仅提供元素 C、普鲁士蓝中与的配位数均为6 D、普鲁士蓝的每个晶胞中实际含有3个10. 下列实验方案设计、现象和结论都正确的是( )选项
实验目的
实验方案设计
现象和结论
A
证明碳酸钠遇水放热
向碳酸钠粉末中加少量水,观察现象并用手碰触试管外壁
结块,试管外壁变热,说明生成含有结晶水的碳酸钠晶体,同时放出热量
B
蛋白质在某些物质作用下变性
向蛋白质溶液中加入浓溶液
得白色浑浊,说明蛋白质发生了变性
C
检验1-溴丁烷消去产物
取适量、1-溴丁烷、无水乙醇,共热,将产生的气体直接通入酸性溶液中
酸性溶液紫红色褪去,有1-丁烯生成
D
证明某无色溶液中含有
取少量溶液,加入盐酸后,滴入溶液,观察现象
滴入溶液后,立即产生白色沉淀,说明原溶液中含有
A、A B、B C、C D、D11. 某反应的速率方程为 , 其半衰期(当剩余的反应物恰好是起始的一半时所需的时间)为。当其他条件不变,改变反应物浓度时,反应的瞬时速率如表所示:0.25
0.50
1.00
0.50
1.00
0.050
0.050
0.100
0.100
0.200
0.200
v/(mol-1∙L-1∙min-1)
下列说法正确的是( )
A、该反应的速率方程中的 B、该反应的速率常数 C、表格中的 D、在过量的B存在时,反应掉93.75%的A所需的时间是12. 甲酸钠燃料电池是一种膜基碱性电池,提供电能的同时可以获得烧碱,其工作原理如图所示,下列有关说法正确的是( ) A、CEM隔膜为质子交换膜 B、甲为电池负极,电极反应为: C、电池在工作时,乙极附近溶液增大 D、单位时间内甲极产生的与乙极消耗的物质的量之比为13. L-脯氨酸催化有机反应的机理如图所示(
A、CEM隔膜为质子交换膜 B、甲为电池负极,电极反应为: C、电池在工作时,乙极附近溶液增大 D、单位时间内甲极产生的与乙极消耗的物质的量之比为13. L-脯氨酸催化有机反应的机理如图所示( 、
、 分别表示向纸面内、向外伸展的共价键)。下列叙述错误的是( )
分别表示向纸面内、向外伸展的共价键)。下列叙述错误的是( )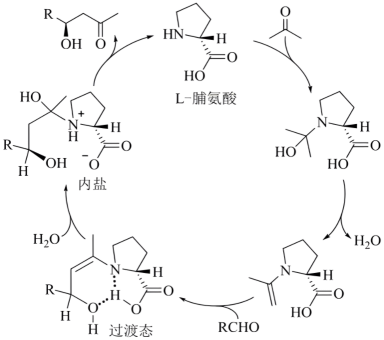 A、L-脯氨酸的化学式为: B、过渡态中存在分子内氢键 C、若 , 则内盐中含有3个手性原子 D、图中总过程的化学方程式可表示为:
A、L-脯氨酸的化学式为: B、过渡态中存在分子内氢键 C、若 , 则内盐中含有3个手性原子 D、图中总过程的化学方程式可表示为: 14. 是中学化学常见的药品之一,其相图(时,用于描述体系共存形式的平衡曲线)见图,已知溶解度随温度变化不大,则下列有关说法错误的是( )
14. 是中学化学常见的药品之一,其相图(时,用于描述体系共存形式的平衡曲线)见图,已知溶解度随温度变化不大,则下列有关说法错误的是( ) A、0℃时,的溶解度约为 B、对海水进行冷冻,可获取淡水资源 C、由饱和溶液中析出的晶体是否带结晶水主要由结晶速率决定 D、5℃时,取适量20%的溶液于洁净试管中,用玻璃棒刮擦试管内壁后无明显现象15. 常温下,用的溶液滴定的二元酸溶液。溶液中,分布系数随的变化关系如图所示[例如的分布系数:]。下列叙述正确的是( )
A、0℃时,的溶解度约为 B、对海水进行冷冻,可获取淡水资源 C、由饱和溶液中析出的晶体是否带结晶水主要由结晶速率决定 D、5℃时,取适量20%的溶液于洁净试管中,用玻璃棒刮擦试管内壁后无明显现象15. 常温下,用的溶液滴定的二元酸溶液。溶液中,分布系数随的变化关系如图所示[例如的分布系数:]。下列叙述正确的是( ) A、曲线①代表 B、滴加溶液体积为时,溶液中 C、的水解常数 D、a点时溶液中
A、曲线①代表 B、滴加溶液体积为时,溶液中 C、的水解常数 D、a点时溶液中二、非选择题
-
16. 四氯化锡是一种重要的化工原料,主要用于有机锡化合物的制造,也可用作分析试剂、有机合成脱水剂等。已知锡单质在加热时可直接与氯气化合生成 , 某实验小组用如下装置对其进行合成。
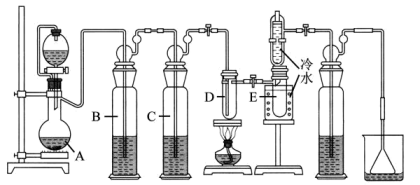
【相关药品性质】
药品
颜色、状态
熔点(℃)
沸点(℃)
其他性质
银白色固体
231
2260
较活泼金属能与、等气体发生反应
无色液体
114
极易水解产生溶胶
请回答下列问题:
(1)、仪器A的名称是;(2)、写出水解的化学方程式。将少量置于空气中可观察到的现象是;(3)、检验装置气密性后,向A中装入固体,小试管D内装入片,恒压滴液漏斗中加入浓盐酸,(填“操作”及“现象”),点燃酒精灯开始反应;(4)、若无洗气瓶B,可能会导致的问题是;洗气瓶C中所盛放的药品是;(5)、试验结束后,小试管E内收集到的液体呈淡黄色,其原因是;(6)、碳与锡可形成多种氯化物,其沸点如下:氯化物
沸点(℃)
76
623(分解)*
114
*注:加热至623℃,未沸腾直接分解
解释表中氯化物沸点差异的原因。
17. 随着工业的发展,氨氮废水(主要含)的排放对环境造成很大的影响,常见的处理方法有:生物脱氮法、吹脱-氧化法、电化学氧化法等。请回答下列问题:(1)、氨氮废水排放最直接的影响是加速水体富营养化,可造成(填写一个可出现的环境问题);(2)、生物脱氮法流程如下:
①两步反应的最佳温度为35℃,当温度低于5℃,反应接近停止的原因是;
②步骤I中若的消除速率为 , 则的消耗速率为;
(3)、吹脱-氧化法:①吹脱时,与在溶液中存在下述平衡: , 如图是不同温度下,水中与随变化的相对含量图:

由图像可知,越大,水中含量越高,其原因是。50℃平衡的平衡常数;
②氧化原理如下:

(i)其他条件相同时,向一定体积的氨氮废水中通入 , 根据上述原理推测下列说法错误的是(填代号);
a.该过程中N元素既有被氧化的过程又有被还原的过程
b.优良的催化剂不但能降低的活化温度,还能提升的平衡转化率
c.单位时间内生成的活性氧(O·)越多,对转化为无害物越有利
d.随着温度升高、单位时间内的转化率提升说明该转化一定是吸热反应
(ii)其他条件相同,不同催化剂X、Y在发生催化作用时,对比结果如下:
催化剂
转化温度(℃)
转化率(%)
选择性(%)
X
250
90
50
Y
225
90
90
X催化剂Y催化剂(填“优于”或“劣于”);
(4)、电化学氧化法:其原理为电解时阳极产生的羟基自由基氧化或成为而被去除。实验结果表明,当溶液中存在时,或转化率大幅提升(如图所示),其可能的原因是。
 18. 钼酸钠是一种金属缓蚀剂,金属钼是重要的合金材料,下图是由辉钼矿(钼元素的主要存在形式为)生产两种物质的流程:
18. 钼酸钠是一种金属缓蚀剂,金属钼是重要的合金材料,下图是由辉钼矿(钼元素的主要存在形式为)生产两种物质的流程:
请回答下列问题:
(1)、为第五周期元素,与同族,其基态原子价层电子排布式为;(2)、辉钼矿在空气中焙烧时,加入氧化物X可减少空气污染物的排放,烧渣中以的形态存在,则X为(填化学式),焙烧方程式为;(3)、已知:25℃时, , 则该温度下,饱和溶液中的浓度为;(4)、溶液在对烧渣进行浸出时,温度对浸出率的影响如下图所示:
“操作1”需选择“高压浸出”的理由是;
(5)、从上述流程中可分析出属于(填“酸性氧化物”或“碱性氧化物”);(6)、由获得可以选择做还原剂,相关说法正确的是(填代号);a.其原理属于热还原法冶金
b. 的金属活动性可能位于、之间
c.工业上可用与钼酸盐溶液直接作用冶炼钼
(7)、已知晶体有类似石墨的层状结构,预测其可能的用途是。19. 盐酸哌替啶是一种镇痛药,其合成路线如下:
请回答下列问题:
(1)、芳香烃A的结构简式为 , 反应①选择的无机反应物和反应条件是;(2)、D的同分异构体有多种,满足分子中只含有一种官能团且除苯环外无其他环状结构的化合物共有种,写出其中能发生银镜反应且只有一个支链的化合物的结构简式;(3)、E→F的转化需要加入环氧乙烷( ),以下是由乙烯合成环氧乙烷的两种方法:
),以下是由乙烯合成环氧乙烷的两种方法:(i)

(ii)

试从绿色化学的角度评价两种方法的优劣;
(4)、H是最简单的胺类物质,G与H的反应发生在和之间(填官能团名称);(5)、请运用学过的知识并结合上述流程,写出以氯乙烷为有机原料合成丙酸乙酯的合成路线 (其他无机试剂任选,合成路线流程图示例见本题题干)。