安徽省蚌埠市2023年高三下学期第三次教学质量检查考试理综化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 勤洗手是预防细菌和病毒感染简单而有效的方法。一种免洗洗手液成分为三氯羟基二苯醚乙醇、甘油等,下列有关此洗手液的说法错误的是( )A、应远离火源,避光存放 B、甘油可以起到保湿作用 C、其消毒原理与“84”消毒液的不同 D、启用后,可长期使用而不会降低消毒效果2. 某抗癌、抗癫痫药物中间体M的结构如图所示。下列有关M的说法正确的是( )
 A、碳原子和氧原子的杂化方式均有两种 B、分子中最多有9个碳原子共面 C、与溴水发生反应时,1 mol M最多消耗4 mol Br2 D、可发生加成反应、氧化反应、水解反应3. 与锂离子电池相比,有机电池不依赖战略金属、充电速度更快且环境友好。如图是一种可降解的多肽电池。(假设离子交换膜仅允许通过)下列说法错误的是( )
A、碳原子和氧原子的杂化方式均有两种 B、分子中最多有9个碳原子共面 C、与溴水发生反应时,1 mol M最多消耗4 mol Br2 D、可发生加成反应、氧化反应、水解反应3. 与锂离子电池相比,有机电池不依赖战略金属、充电速度更快且环境友好。如图是一种可降解的多肽电池。(假设离子交换膜仅允许通过)下列说法错误的是( )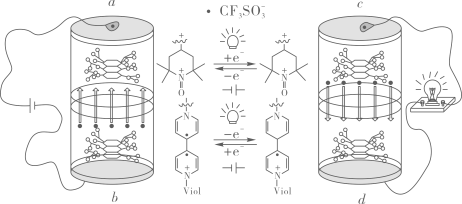 A、放电时d为正极,充电时b为阴极 B、c电极的电极方程式为:
A、放电时d为正极,充电时b为阴极 B、c电极的电极方程式为: C、放电时,电路中每通过NA个电子,负极区质量增加149g
D、充电时,总反应方程式为:
C、放电时,电路中每通过NA个电子,负极区质量增加149g
D、充电时,总反应方程式为:  4. X、Y、Z、W是前4周期原子序数依次增大的主族元素,X在周期表中非金属性最强,Y的周期序数与族序数相等,Z原子次外层电子数是核外电子总数的一半,基态W原子核外16个轨道上填有电子。下列说法正确的是( )A、原子半径:r(X) <r(Y) <r(Z) <r(W) B、Z的简单气态氢化物沸点比X的高 C、第一电离能:I1(W) <I1(Y) <I1(Z) D、W最高价氧化物对应的水化物为可溶性强碱5. 下列实验操作、现象和结论一致的是( )
4. X、Y、Z、W是前4周期原子序数依次增大的主族元素,X在周期表中非金属性最强,Y的周期序数与族序数相等,Z原子次外层电子数是核外电子总数的一半,基态W原子核外16个轨道上填有电子。下列说法正确的是( )A、原子半径:r(X) <r(Y) <r(Z) <r(W) B、Z的简单气态氢化物沸点比X的高 C、第一电离能:I1(W) <I1(Y) <I1(Z) D、W最高价氧化物对应的水化物为可溶性强碱5. 下列实验操作、现象和结论一致的是( )选项
操作
现象
解释(或结论)
A
向补铁口服液中滴加几滴酸性KMnO4溶液
紫色褪去
补铁口服液中有Fe2+
B
向I2水中先加浓NaOH溶液,再加CCl4 , 振荡后静置
液体分层, 上层无色,下层紫红色
CCl4能萃取碘水中的碘,而NaOH溶液不能
C
向盛有1 mL乙酸乙酯的a、b两支试管中分别加入2 mL H2O、2 mLNaOH溶液,70 ~ 80℃热水浴
试管 a液体分层,酯层无明显 变化; 试管b酯层消失
乙酸乙酯在碱性条件下可以水解;
D
向Fe(NO3)3溶液中先加稀HNO3 ,再加NaCl
溶液黄色先褪去,再变为黄色
HNO3的强氧化性将Fe3+氧化为无色, Cl-的还原性再将其还原为Fe3+
A、A B、B C、C D、D6. 1889 年,Arrhenius提出了反应速率常数k随温度的变化关系lnk=(R,C均为常数)。已知2NO(g) +O2(g) 2NO2(g) ,经历反应1和反应2两步:反应1:2NO(g) N2O2(g) ΔH1= -46.3 kJ· mol-1
反应2:N2O2(g) +O2(g)2NO2(g) ΔH2= -65. 7 kJ·mol-1
两步反应的活化能Ea1 < Ea2。某课题组通过实验绘制出两步反应lnK、lnk随 的变化曲线如图所示(K表示平衡常数) ,下列说法中错误的是( )
 A、2molNO与1molO2充分反应,放出热量小于112kJ B、曲线③表示的是k2随的变化关系 C、温度越高,单位时间内NO的转化率可能越低 D、相同条件下,O2浓度的变化比NO浓度的变化对反应速率影响更显著7. 百里酚蓝(以下记为H2A)是一种有机弱酸,结构如图1所示,其电离平衡可表示为:
A、2molNO与1molO2充分反应,放出热量小于112kJ B、曲线③表示的是k2随的变化关系 C、温度越高,单位时间内NO的转化率可能越低 D、相同条件下,O2浓度的变化比NO浓度的变化对反应速率影响更显著7. 百里酚蓝(以下记为H2A)是一种有机弱酸,结构如图1所示,其电离平衡可表示为:25℃时0.1 mol·L-1溶液中,H2A、HA-、A2-的分布分数 δ与pH的变化关系如图2所示。 已知: δ(A2-) =

下列说法错误的是( )
A、溶液由黄色变为蓝色原因是酚羟基发生了变化 B、δ(HA-)= C、pH=7.0:c(HA-) >c(A2-) >c(H2A) >c(H+) =c(OH- ) D、NaOH 滴定CH3COOH,可用H2A作指示剂,溶液由红色变为橙色且半分钟内不复原即为滴定终点二、非选择题
-
8. 实验室制取溴苯的装置如图所示。向二颈烧瓶中先滴入0.5 mL Br2 , 静置,经片刻诱导期后反应开始。再缓慢滴加其余的Br2 , 维持体系微沸至Br2加完,70~ 80℃水浴15min。(诱导期:催化反应中形成过渡态且总反应速率为0的时期)反应结束后产品处理:


有关数据如下:
物质
苯
溴
溴苯
密度(g· cm-3)
0.88
3.12
1.50
沸点/℃
80
59
156
在水中的溶解性
不溶
微溶
不溶
回答下列问题:
(1)、仪器a的名称是。(2)、溴苯的制备需在无水条件下进行,原因是。(3)、A装置盛装( 填试剂)用于检验诱导期已过,反应开始。(4)、当出现 ( 填现象)时,证明反应已结束。(5)、产品后处理阶段,有机层I用10% NaOH溶液洗涤其离子反应方程式为 , 有机层Ⅱ水洗的目的是。(6)、有机层Ⅲ经干燥后分离出纯净溴苯的操作名称是。9. 可利用炼锌矿渣(主要含Ga2O3·3Fe2O3 , ZnO·Fe2O3)制备半导体材料GaN并分离Fe和Zn ,其工艺流程如图所示:
已知:①镓又称为“类铝”,其性质与铝类似;
②一些金属离子开始沉淀和沉淀完全的pH及萃取率如下表所示:
金属离子
Fe3+
Ga3+
Zn2+
Fe2+
开始沉淀
1.7
3.0
5.5
8.0
沉淀完全
3.2
4.9
8.0
9.6
萃取率(%)
99
97 ~98. 5
0
0
回答下列问题:
(1)、过滤后,滤液的主要成分是(填化学式)。(2)、固体M为 , 其作用是。(3)、反萃取的离子方程式为。(4)、合成得到的产物是( CH3 )3Ca,经化学气相沉积(类似于取代反应) ,副产物为 (填名称)。(5)、GaN晶体结构如图所示,其中Ga原子采取堆积,N原子填在Ga原子所形成的正四面体空隙中,则正四面体空隙的填隙率为。(填隙率=) 10. 能源的合理开发和利用,低碳减排是人类正在努力解决的大问题。2023 年2月21日,中国气候变化特使谢振华获得首届诺贝尔可持续发展特别贡献奖,以表彰他在全球生态保护中做出的贡献(1)、在298K、100kPa时,已知:
10. 能源的合理开发和利用,低碳减排是人类正在努力解决的大问题。2023 年2月21日,中国气候变化特使谢振华获得首届诺贝尔可持续发展特别贡献奖,以表彰他在全球生态保护中做出的贡献(1)、在298K、100kPa时,已知:C(s,石墨) +O2(g)=CO2(g) ΔH1= -393.5 kJ·mol-1
H2(g) +O2(g)=H2O(1) ΔH2= -285.8 kJ· mol-1
2C2H2(g) +5O2 (g)= 4CO2(g) +2H2O(1) ΔH3= -2599.0 kJ·mol-1
在298K时由C(s,石墨)和H2(g)反应生成1 mol C2H2(g) 的热化学方程式为。
(2)、在固相催化剂作用下CO2加氢合成甲烷过程中发生以下两个反应:主反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH1=-156.9kJ· mol-1
副反应:CO2(g) +H2(g) CO(g) + H2O(g) ΔH2= +41.1 kJ·mol -1
工业合成甲烷通常控制温度为500℃左右,其主要原因为。
(3)、向密闭容器中充入一定量的CH4(g)和NO(g) ,保持总压为100kPa发生反应:CH4(g) +4NO(g) 2N2(g) +CO2(g) +2H2O(g) ΔH <0。
当=1时,NO的平衡转化率~;T2时NO平衡转化率~的关系如图

①能表示此反应已经达到平衡的是。
A.气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
C. 不再变化
②表示T2时NO平衡转化率~的关系是(填“I”或“II”),T1T2(填“>”或“<”)。
③在=1、T2时,CH4的平衡分压为 。已知:该反应的标准平衡常数 , 其中=100 kPa,p(CH4)、p(NO)、p(CO)2、 p(N2)和p( H2O)为各组分的平衡分压,则该温度下 =。(分压=总压 ×物质的量分数。计算结果用分数表示)。
11. 受体拮抗剂是指能与受体结合,但不具备内在活性的一类物质。 某受体拮抗剂的中间体G的合成路线如下:
已知:①

②R-CN R-COOH
请回答:
(1)、化合物C的分子式是 , 其含氧官能团的名称是。(2)、由A生成B的反应类型是。(3)、已知:碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。写出化合物G与足量H2发生加成反应产物的结构简式,并田*标出其中的手性碳原子。(4)、化合物M是比B少一个碳原子的同系物,请写出符合以下四个条件的同分异构体的结构简式。①遇FeCl3溶液发生显色反应
②苯环上连有两个取代基
③核磁共振氢谱有5组吸收峰
④1 mol物质与足量NaHCO3溶液反应最多产生1 mol CO2
(5)、写出E→F的化学方程式。(6)、以化合物 等为原料,设计合成化合物
等为原料,设计合成化合物 的路线(用流程图表示,无机试剂、有机溶剂任选)。
的路线(用流程图表示,无机试剂、有机溶剂任选)。