辽宁省沈阳市三校2023年高三下学期联合模拟考试化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 化学在社会进步中发挥着关键性作用。下列有关能源和材料的说法错误的是A、低磁合金钢常用于舰体材料,其强度高于纯铁 B、可燃冰资源丰富且可再生,是最有希望的未来能源 C、利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” D、稀土元素被称为“冶金工业的维生素”,其加入钢中后可增加钢的韧性、抗氧化性2. 亚硝酰氟(FNO)是一种工业稳定剂,可通过反应N2O4 +CsF=FNO+CsNO3制得。下列说法正确的是A、氧原子的结构示意图为
 B、CsF的电子式为
B、CsF的电子式为 C、FNO的空间构型为直线形
D、CsNO3中含有离子键与共价键
3. 制备的反应:。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含的数目为 B、(标准状况下)中含电子数目为 C、中含非极性共价键的数目为 D、完全参加反应,转移电子数为4. 某种天然生物活性物质结构如下图所示,下列说法错误的是
C、FNO的空间构型为直线形
D、CsNO3中含有离子键与共价键
3. 制备的反应:。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含的数目为 B、(标准状况下)中含电子数目为 C、中含非极性共价键的数目为 D、完全参加反应,转移电子数为4. 某种天然生物活性物质结构如下图所示,下列说法错误的是 A、分子中有两种含氧官能团 B、苯环上的一氯代物共有6种 C、可发生取代反应和加成反应 D、完全水解可得3种有机产物5. W、X、Y、Z为原子序数依次增大的短周期元素。W原子的核外电子只有一种运动状态;X与Z同主族,X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同;Y元素原子中只有两种形状的电子云,最外层没有成对电子。下列说法正确的是A、非金属性:W>X B、最简单氢化物的键角:X<Z C、简单离子半径:Y>X D、四种元素的氧化物都至少有两种6. 下列实验操作能够达到目的的是
A、分子中有两种含氧官能团 B、苯环上的一氯代物共有6种 C、可发生取代反应和加成反应 D、完全水解可得3种有机产物5. W、X、Y、Z为原子序数依次增大的短周期元素。W原子的核外电子只有一种运动状态;X与Z同主族,X元素基态原子最高能级的不同轨道都有电子,并且自旋方向相同;Y元素原子中只有两种形状的电子云,最外层没有成对电子。下列说法正确的是A、非金属性:W>X B、最简单氢化物的键角:X<Z C、简单离子半径:Y>X D、四种元素的氧化物都至少有两种6. 下列实验操作能够达到目的的是



A.验证铁钉的吸氧腐蚀
B.比较和对的催化效果
C.测定中和反应的反应热
D.用酸性高锰酸钾溶液滴定硫酸亚铁溶液
A、A B、B C、C D、D7. 下列反应的离子方程式正确的是A、中投入固体: B、邻羟基苯甲醛中加入足量浓溴水: C、二元弱酸亚磷酸()溶液中滴加少量的NaOH溶液:
D、溶液中滴加足量溶液:
8. 硅及其化合物广泛应用于光电材料领域,其中SiCl4与N-甲基咪唑(
C、二元弱酸亚磷酸()溶液中滴加少量的NaOH溶液:
D、溶液中滴加足量溶液:
8. 硅及其化合物广泛应用于光电材料领域,其中SiCl4与N-甲基咪唑( )反应可以得到M2+ , 其结构如图所示。下列叙述错误的是
)反应可以得到M2+ , 其结构如图所示。下列叙述错误的是 A、SiCl4的空间构型为正四面体 B、1个M2+中含有42个σ键。 C、H、C、N的电负性由大到小的顺序为N>C>H D、N-甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp39. 处理烟气中的可以采用碱吸——电解法,其流程如图1;模拟过程Ⅱ如图2,下列推断错误的是
A、SiCl4的空间构型为正四面体 B、1个M2+中含有42个σ键。 C、H、C、N的电负性由大到小的顺序为N>C>H D、N-甲基咪唑分子中碳原子的杂化轨道类型为sp2、sp39. 处理烟气中的可以采用碱吸——电解法,其流程如图1;模拟过程Ⅱ如图2,下列推断错误的是
 A、电解溶液时,亚硫酸根离子通过阴离子交换膜进入右室 B、若用锌锰碱性电池为电源,a极与锌极相连 C、a极的电极反应式为 D、若收集22.4L的P(标准状况下),则转移4mol电子10. 2022年诺贝尔化学奖授予了在点击化学方面做出贡献的科学家。一种点击化学反应如下:
A、电解溶液时,亚硫酸根离子通过阴离子交换膜进入右室 B、若用锌锰碱性电池为电源,a极与锌极相连 C、a极的电极反应式为 D、若收集22.4L的P(标准状况下),则转移4mol电子10. 2022年诺贝尔化学奖授予了在点击化学方面做出贡献的科学家。一种点击化学反应如下:
用NA表示阿伏加德罗常数,下列说法正确的是
A、该反应的原子利用率为100% B、标况下,22.4 L X物质含有NA个手性碳原子 C、Y物质存在顺反异构体 D、常温时1mol Z物质含8NA个碳碳双键11. 下图是用钌基催化剂催化和的反应示意图,当反应生成液态时放出的热量。下列说法错误的是 A、反应历程中存在极性键、非极性键的断裂与形成 B、图示中物质I为该反应的催化剂,物质II、III为中间产物 C、使用催化剂可以降低反应的活化能,但无法改变反应的焓变 D、由题意知:12. 氢还原辉钼矿并用碳酸钠作固硫剂的原理为MoS2(s)+4H2(g)+2Na2CO3(s)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。平衡时的有关变化曲线如图。下列说法正确的是
A、反应历程中存在极性键、非极性键的断裂与形成 B、图示中物质I为该反应的催化剂,物质II、III为中间产物 C、使用催化剂可以降低反应的活化能,但无法改变反应的焓变 D、由题意知:12. 氢还原辉钼矿并用碳酸钠作固硫剂的原理为MoS2(s)+4H2(g)+2Na2CO3(s)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。平衡时的有关变化曲线如图。下列说法正确的是 A、该反应在低温下可以自发进行 B、粉碎矿物和增大压强都有利于辉钼矿的还原 C、图2中T1对应图1中的温度为1300℃ D、若图1中A点对应温度下体系压强为10MPa,则H2O(g)的分压为5MPa13. 根据下列操作及现象,所得结论正确的是
A、该反应在低温下可以自发进行 B、粉碎矿物和增大压强都有利于辉钼矿的还原 C、图2中T1对应图1中的温度为1300℃ D、若图1中A点对应温度下体系压强为10MPa,则H2O(g)的分压为5MPa13. 根据下列操作及现象,所得结论正确的是操作及现象
结论
A
向溶有SO2的BaCl2溶液中加入Fe(NO3)3溶液,有白色沉淀生成
说明NO具有强氧化性
B
向2mL浓度均为0.1mol•L-1的NaBr与Na2S混合溶液中滴加2滴0.1mol•L-1的AgNO3溶液,只有黑色沉淀生成
说明Ag2S比AgBr更难溶
C
取4mL乙醇,加入12mL浓硫酸及少量沸石,迅速升温至170℃,将产生的气体进入2mL溴水中,溴水褪色
说明乙醇消去反应的产物为乙烯
D
向丙烯醛中加入足量新制氢氧化铜悬浊液,加热至不再生成砖红色沉淀,静置,向上层清液滴加溴水,溴水褪色
说明丙烯醛中含有碳碳双键
A、A B、B C、C D、D14. 应用电化学方法,对水体消毒并去除余氯,装置如下图所示。下列说法正确的是 A、闭合后,可对池中的水杀菌消毒 B、断开 , 闭合时,由M极流出 C、断开 , 闭合后,N极金属不断累积 D、钠离子交换膜可用质子交换膜代替15. 室温下,用NaOH溶液分别滴定体积均为20mL、浓度均为的HCl和HX溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列说法错误的是
A、闭合后,可对池中的水杀菌消毒 B、断开 , 闭合时,由M极流出 C、断开 , 闭合后,N极金属不断累积 D、钠离子交换膜可用质子交换膜代替15. 室温下,用NaOH溶液分别滴定体积均为20mL、浓度均为的HCl和HX溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列说法错误的是 A、HX的电离平衡常数 B、M点存在: C、将P点和N点的溶液混合,溶液呈酸性 D、向N点的溶液中通入HCl气体至pH=7:
A、HX的电离平衡常数 B、M点存在: C、将P点和N点的溶液混合,溶液呈酸性 D、向N点的溶液中通入HCl气体至pH=7:二、非选择题
-
16. 氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱镁矿石的主要的成分是 , 还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[]形成氢氧化物沉淀时的pH如下:
金属离子
开始沉淀的pH
3.8
1.5
6.3
10.6
8.8
9.6
沉淀完全的pH
5.2
2.8
8.3
12.6
10.8
11.6
③常温下,、的溶度积分别为、。
回答下列问题:
(1)、“焙烧”时发生的主要化学反应方程式为。(2)、浸出液“净化除杂”过程如下:首先加入 , 将氧化为 , 反应的离子方程式为。然后调节溶液pH使、沉淀完全,此时溶液的pH范围为。再加入沉淀、 , 当时,。(3)、流程中能循环利用的固态物质是。(4)、某种含Zn、Mn特殊材料的晶胞结构如图所示,该物质的化学式为。若该晶体的密度为 , 则晶体中相邻N之间的最短距离为nm(列出计算式,为阿伏加德罗常数的值)。 17. 某实验小组探究浅黄色草酸亚铁晶体()分解产物的装置如图所示。
17. 某实验小组探究浅黄色草酸亚铁晶体()分解产物的装置如图所示。
回答下列问题:
(1)、仪器M的名称是。(2)、点燃酒精灯之前,先通入 , 其目的是。(3)、装置C的作用是。(4)、如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有(填化学式)。(5)、在300℃、500℃下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:实验
实验操作及现象
①
用强磁铁接近甲,无明显现象;将黑色粉末溶于稀硫酸,滴加溶液,产生蓝色沉淀
②
用强磁铁接近乙,吸起部分粉末,将吸起来的粉末投入盐酸中,产生气泡;将剩余黑色粉末溶于稀硫酸,滴加溶液,产生蓝色沉淀
根据上述实验,实验①产生蓝色沉淀的离子方程式为。乙中的成分可能为(填化学式)。
(6)、测定草酸亚铁晶体()纯度。准确称取W g样品于锥形瓶,加入适量的稀硫酸,用c 溶液滴定至终点,消耗溶液b mL。滴定反应:(未配平)。该样品纯度为%。若滴定管没有用待装液润洗,测得结果(填“偏高”、“偏低”或“无影响”)。18. 我国力争2030年前实现碳达峰,2060年前实现碳中和。的综合利用是实现碳中和的措施之一。(1)、生产尿素:①尿素的合成分两步进行:
a.
b.
则总反应的ΔH=。
②如图为时,温度对的转化率的影响。解释温度升高的平衡转化率增大的原因:
 (2)、已知制备甲醇的有关化学反应如下:
(2)、已知制备甲醇的有关化学反应如下:①甲醇还可以与乙酸反应制香料,反应方程式为 , 制香料反应的平衡常数K的表达式为。
②850℃时,反应的平衡常数K=160,在密闭容器中进行该反应,开始时只加入、 , 反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
物质
浓度/()
0.2
0.2
0.4
0.4
(3)、一定温度下,在体积为2L的恒容密闭容器中加入4mol CO(g)和4mol (g)发生反应 , 测得CO(g)和(g)的物质的量随时间的变化如图所示:
①从反应开始至达到化学平衡时,以表示的平均化学反应速率为。
②若该反应的正、逆反应速率分别可表示为 , , 、分别为正、逆反应速率常数, A、B两点对应的时刻,该反应的正反应速率之比。
③若平衡时总压强为pkPa,用平衡分压代替其平衡浓度表示的化学平衡常数 [已知:气体分压()=气体总压()×该气体的体积分数]。
19. 布洛芬具有抗炎、止痛、解热的作用。以有机物A为原料制备布洛芬的一种合成路线如图所示。回答下列问题:
已知:

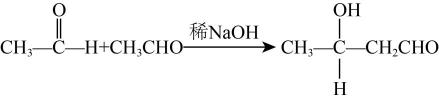 (1)、C中官能团的名称是 , D的名称是。(2)、B→C的反应类型。(3)、下列有关布洛芬的叙述正确的是。
(1)、C中官能团的名称是 , D的名称是。(2)、B→C的反应类型。(3)、下列有关布洛芬的叙述正确的是。a.能发生取代反应,不能发生加成反应
b.1mol该物质与足量碳酸氢钠反应理论上可生成44g
c.布洛芬分子中最多有11个碳原子共平面
d.1mol布洛芬分子中含有手性碳原子物质的量为2mol
(4)、满足下列条件的布洛芬的同分异构体有种,写出其中能发生银镜反应且核磁共振氢谱峰面积比为12:2:2:1:1的物质的结构简式。(写一种即可)①苯环上有三个取代基,苯环上的一氯代物有两种
②能发生水解反应,且水解产物之一能与溶液发生显色反应
(5)、缓释布洛芬能缓慢水解释放出布洛芬,请将下列方程式补充完整。 。
。