新疆阿勒泰地区2023届高考素养调研第一次模拟考试理科综合化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 化学与生产、生活、环境等密切相关。下列说法正确的是A、向天然水中加入明矾可起到杀菌消毒的作用 B、淀粉、纤维素在人体内最终的水解产物均为CO2和H2O C、用风能发电可减少温室气体排放 D、C919国产大飞机风挡结构部分使用的有机玻璃属于硅酸盐材料2. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、常温下22.4L NH3含有的中子数为7NA B、常温下1L pH=13的Ba(OH)2溶液中OH-的数目为0.2NA C、将50mL 12mol/L盐酸与足量 共热,转移的电子数为0.3NA D、56g C3H6和C4H8的混合气体中含有的氢原子数为8NA3. 利用下列装置(夹持部分略)和试剂进行实验,能达到实验目的的是A、
 制备SO2
B、
制备SO2
B、 制备并收集少量NO
C、
制备并收集少量NO
C、 配制NaCl溶液
D、
配制NaCl溶液
D、 观察铁的析氢腐蚀
4. 有机物M是合成抗过敏药物色甘酸钠的中间体,结构简式如图。下列关于该有机物的说法正确的是
观察铁的析氢腐蚀
4. 有机物M是合成抗过敏药物色甘酸钠的中间体,结构简式如图。下列关于该有机物的说法正确的是 A、分子中只含有醚键、酯基两种官能团 B、能与NaOH溶液反应 C、苯环上的一氯取代物有4种 D、所有碳原子不可能共平面5. W、X、Y、Z为原子序数依次增大的短周期主族元素,W、Z同主族,Y单质可用作光电池,X的周期序数等于主族序数,Z原子的最外层电子数等于最内层电子数的3倍,下列叙述错误的是A、工业上采用熔融电解法冶炼X的单质 B、含X或Y的某些盐可用于制备胶体 C、简单离子的半径:Z>W>X D、YW2和ZW2都是酸性氧化物,都不与酸反应6. 我国科学家近期开发了一种高性能的水系锰基锌电池。 其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。下列说法正确的是
A、分子中只含有醚键、酯基两种官能团 B、能与NaOH溶液反应 C、苯环上的一氯取代物有4种 D、所有碳原子不可能共平面5. W、X、Y、Z为原子序数依次增大的短周期主族元素,W、Z同主族,Y单质可用作光电池,X的周期序数等于主族序数,Z原子的最外层电子数等于最内层电子数的3倍,下列叙述错误的是A、工业上采用熔融电解法冶炼X的单质 B、含X或Y的某些盐可用于制备胶体 C、简单离子的半径:Z>W>X D、YW2和ZW2都是酸性氧化物,都不与酸反应6. 我国科学家近期开发了一种高性能的水系锰基锌电池。 其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。下列说法正确的是 A、电子流向:Zn电极→b膜→a膜→MnO2电极→负载→Zn电极 B、负极的电极反应式为MnO2+2e-+4H+=Mn2++2H2O C、a膜为阴离子交换膜,b膜为阳离子交换膜 D、装置工作一段时间后,正极区溶液的pH降低7. 相同温度和压强下,研究Cl2分别在不同浓度的盐酸和NaCl溶液中的溶解度(用溶解Cl2的物质的量浓度表示)变化如图所示。
A、电子流向:Zn电极→b膜→a膜→MnO2电极→负载→Zn电极 B、负极的电极反应式为MnO2+2e-+4H+=Mn2++2H2O C、a膜为阴离子交换膜,b膜为阳离子交换膜 D、装置工作一段时间后,正极区溶液的pH降低7. 相同温度和压强下,研究Cl2分别在不同浓度的盐酸和NaCl溶液中的溶解度(用溶解Cl2的物质的量浓度表示)变化如图所示。
已知氯气溶解存在以下过程:
①Cl2(aq) + H2O(1) H+(aq) + Cl-(aq) + HClO(aq) K1= 4.2×10-4
②Cl2(aq) + Cl-(aq) (aq) K2= 0.19
③HClO(aq) H+(aq) + ClO-(aq) Ka= 3.2×10-8
下列说法错误的是
A、随着NaCl浓度的增大,Cl2溶解度减小,溶液中减小 B、随着盐酸浓度的增大,反应①被抑制,反应②为主要反应从而促进Cl2溶解 C、a点时,c(H+) >c(Cl-)>c() > c(ClO-) D、b点时,c(Na+) + c(H+) = c(Cl-) + c() + c(OH-) + c(ClO-)二、非选择题
-
8. 为保护环境,充分利用钴资源,一种以废旧钴酸锂电池材料(正极材料主要含有LiCoO2、铝箔及金属钢壳)回收钴酸锂的工艺流程如下:

已知一定条件下,部分金属阳离子形成氢氧化物的pH如下表:
离子
Co3+
Fe3+
Co2+
Fe2+
Al3+
开始沉淀的pH
0.3
2.7
7.2
7.6
3.6
完全沉淀的pH
1.1
3.2
9.2
9.6
5.2
请回答下列问题:
(1)、废旧钴酸锂电池需经放电、拆解、粉碎预处理。放电方式为电化学放电,可以将废旧电池浸泡在(填标号)中进行放电。粉碎的目的是。A.Na2SO4溶液
B.98%的H2SO4溶液
C.酒精
(2)、“酸浸”过程中,除加入H2SO4 , 还要加入H2O2。①H2O2的作用是(填标号)。
A.做氧化剂
B.做还原剂
C.既做氧化剂又做还原剂
②H2O2促进了LiCoO2在H2SO4中转化为CoSO4 , 该反应的离子方程式为。
③相同条件下,“酸浸”时钴的浸出率随温度变化如右图所示,此时温度控制在80℃左右的原因为。
 (3)、“调pH”时,溶液应控制的pH范围为 , 选用的最佳试剂是 (填标号)。
(3)、“调pH”时,溶液应控制的pH范围为 , 选用的最佳试剂是 (填标号)。A.H2SO4 B.CoCO3 C.石灰乳 D.NaOH
(4)、高温时,CoC2O4和Li2CO3生成LiCoO2的同时放出CO2。此反应的化学方程式为。9. 2022年11月,神舟十五号载人飞船发射任务取得圆满成功。肼(N2H4)可作火箭发射的燃料,具有强还原性,实验室用NH3与Cl2合成N2H4的装置如图所示,请回答下列问题: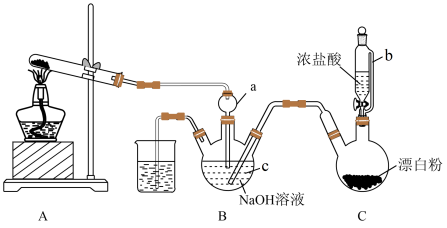 (1)、仪器c的名称为 , 装置中仪器a的作用除了导气还有。(2)、按图连接装置,盛放试剂前,首先要进行操作。(3)、装置D中制备Cl2的化学方程式为 , 导管 b的作用是。(4)、装置C中的试剂是。(5)、装置B中制备N2H4的离子方程式为。(6)、实验室对产品中肼的质量分数进行测定。已知:N2H4+2I2=N2↑ +4HI。取装置B中的溶液6.00g,调节溶液pH为6.5左右,加水配成500mL溶液,移取25.00mL于锥形瓶中,滴加2~3滴淀粉溶液,用0.2000 mol·L1的I2溶液滴定(杂质不参与反应) ,滴定终点的现象是 , 测得消耗I2溶液的体积为20.00 mL,则该产品中N2H4的质量分数为%(保留3位有效数字)。10. 为实现“碳达峰”及“碳中和”,二氧化碳甲烷化技术是CO2循环再利用最有效的技术之一。请回答下列问题:(1)、二氧化碳甲烷化时发生的反应为: CO2(g) + 4H2(g) CH4(g) + 2H2O(g)
(1)、仪器c的名称为 , 装置中仪器a的作用除了导气还有。(2)、按图连接装置,盛放试剂前,首先要进行操作。(3)、装置D中制备Cl2的化学方程式为 , 导管 b的作用是。(4)、装置C中的试剂是。(5)、装置B中制备N2H4的离子方程式为。(6)、实验室对产品中肼的质量分数进行测定。已知:N2H4+2I2=N2↑ +4HI。取装置B中的溶液6.00g,调节溶液pH为6.5左右,加水配成500mL溶液,移取25.00mL于锥形瓶中,滴加2~3滴淀粉溶液,用0.2000 mol·L1的I2溶液滴定(杂质不参与反应) ,滴定终点的现象是 , 测得消耗I2溶液的体积为20.00 mL,则该产品中N2H4的质量分数为%(保留3位有效数字)。10. 为实现“碳达峰”及“碳中和”,二氧化碳甲烷化技术是CO2循环再利用最有效的技术之一。请回答下列问题:(1)、二氧化碳甲烷化时发生的反应为: CO2(g) + 4H2(g) CH4(g) + 2H2O(g)①298 K时,已知相关物质的相对能量如图,则该反应的 ΔH为kJ·mol-1。

②某温度下,向某容积为1 L的恒容密闭容器中充入冒2 mol CO2和5 mol H2 , 5 min时反应达到平衡, CO2的转化率为50% ,该反应的平衡常数K为;能判断该程反应已达化学平衡状态的标志是(填标号)。
A.CO2体积分数保持不变
B.容器中混合气体的质量保持不变
C.混合气体的平均相对分子质量保持不变
D.CO2的生成速率与H2O的生成速率相等
③有利于提高体系中CO2平衡转化率的措施是(填标号)。
A.使用高效催化剂 B.增加CO2投入量
C.延长反应时间| D.及时分离CH4
(2)、催化剂的选择是CO2甲烷化的核心,金属Ni或Ni-CeO2均可作为催化剂。反应相同时间,测得CO2转化率和CH4选择性随温度的变化如图所示。高于320 ℃,以Ni—CeO2为催化剂,CO2转化率略有下降,而以Ni为催化剂,CO2转化率却仍在上升,其原因是。(CH4的选择性=)
 (3)、Ni-CeO2催化CO2加H2生成CH4的反应历程如图所示(吸附在催化剂表面的物种用*标注) ,则发生的副反应的方程式为。
(3)、Ni-CeO2催化CO2加H2生成CH4的反应历程如图所示(吸附在催化剂表面的物种用*标注) ,则发生的副反应的方程式为。 (4)、某温度,在体积为1L的恒容密闭容器中加入1molCO2和4molH2 , 10min后达到平衡,CO2的平衡转化率和CH4的选择性分别为80%、90% ,则CH4的反应速率为。(5)、还可以采用微生物电化学法生产甲烷,装置如图,b电极的电极反应式为。
(4)、某温度,在体积为1L的恒容密闭容器中加入1molCO2和4molH2 , 10min后达到平衡,CO2的平衡转化率和CH4的选择性分别为80%、90% ,则CH4的反应速率为。(5)、还可以采用微生物电化学法生产甲烷,装置如图,b电极的电极反应式为。 11. 钕铁硼磁铁在绝对零度时磁性仅次于钬磁铁,但是在常温下磁性远远强于目前已知的所有永久磁铁。生产钕铁硼磁铁的主要原料有稀土金属钕、纯铁、铝硼及其他稀土原料。(1)、钕(Nd)为60号元素,在周期表中第周期。(2)、①铝原子激发态的电子排布式有(填标号,下同) ,其中能量较高的是。
11. 钕铁硼磁铁在绝对零度时磁性仅次于钬磁铁,但是在常温下磁性远远强于目前已知的所有永久磁铁。生产钕铁硼磁铁的主要原料有稀土金属钕、纯铁、铝硼及其他稀土原料。(1)、钕(Nd)为60号元素,在周期表中第周期。(2)、①铝原子激发态的电子排布式有(填标号,下同) ,其中能量较高的是。A.1s22s22p63s13p2 B.1s22s22p63s2
C.1s22s22p63s23p2 D.1s22s22p63p3
②实验测得AlCl3的实际存在形式为Al2Cl6 , 其分子的球棍模型如图所示。已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于分子(填“极性”或“非极性”),分子中Al采取杂化。
 (3)、硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为 (用元素符号表示)。晶体硼的熔点比晶体硅高,原因是。(4)、羰基铁[ Fe(CO)5]与二茂铁[ Fe(C5H5)2]是两种重要的配合物。测定表明二茂铁中配体环戊二烯离子的结构简式为
(3)、硼元素及与其同周期相邻两种元素第一电离能由大到小的顺序为 (用元素符号表示)。晶体硼的熔点比晶体硅高,原因是。(4)、羰基铁[ Fe(CO)5]与二茂铁[ Fe(C5H5)2]是两种重要的配合物。测定表明二茂铁中配体环戊二烯离子的结构简式为 , 且所有氢原子的化学环境都相同,则下列说法中正确的是____(填标号)。 A、二茂铁的中心粒子与配体间存在离子键,且配体中存在一个键 B、羰基铁中,配位原子为C原子,且配体与CN- 是等电子体 C、两种配合物的中心粒子价电子排布图均为
, 且所有氢原子的化学环境都相同,则下列说法中正确的是____(填标号)。 A、二茂铁的中心粒子与配体间存在离子键,且配体中存在一个键 B、羰基铁中,配位原子为C原子,且配体与CN- 是等电子体 C、两种配合物的中心粒子价电子排布图均为
 D、1 mol羰基铁中有10 NA个σ键和10NA个π键
(5)、已知氮化硼( BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构; 立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
D、1 mol羰基铁中有10 NA个σ键和10NA个π键
(5)、已知氮化硼( BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构; 立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
①六方相氮化硼结构与石墨相似,但是却不导电的原因是。
②立方相氮化硼中,离硼原子最近且等距离的硼原子有个。
③若立方相氮化硼晶胞边长为104 nm,设NA为阿伏加德罗常数的值,则立方相BN晶体的摩尔体积Vm=m3·mol-1 (列出计算式)。
12. 阿利克仑是一种肾素抑制剂,以芳香化合物A为原料合成其中间体I的一种合成路线如下:
请回答下列问题:
(1)、A的化学名称是 , C中含氧官能团的名称为。(2)、F生成G的反应类型是。(3)、E的结构简式为 , F 的分子式为。(4)、B生成C的化学方程式为。(5)、有机物X与E互为同分异构体,已知满足下列条件的X有种。①X为芳香化合物;
②能与FeCl3溶液发生显色反应;
③能发生水解反应。
上述同分异构体中核磁共振氢谱有4组峰,峰面积之比为1:2:2:3的结构简式为 (写出其中一种)。