天津市红桥区2023年高三下学期一模考试化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 化学是材料科学的基础,下列涉及的材料中,主要成分为有机高分子化合物的是A、制造5G芯片的氮化铝晶圆 B、飞船返回仓壳层中的铝合金 C、中国天眼中传输信息用的光导纤维 D、航天服中的合成纤维及尼龙膜2. 下列关于Na和K的比较中正确的是A、原子半径:Na>K B、金属性:Na>K C、第一电离能:Na>K D、还原性:Na>K3. “夏禹铸九鼎,天下分九州”,青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是( )A、青铜器中锡、铅对铜有保护作用 B、青铜的熔点低于纯铜 C、Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类 D、可用FeCl3溶液浸泡青铜器来清洗青铜器的铜锈4. 用NaCl固体配制100 mL 1.00 mol·L-1的溶液,溶解过程如图所示。下列说法正确的是
 A、a为Na+ , b为Cl- B、水分子破坏了NaCl中的离子键 C、NaCl只有在水溶液中才能发生电离 D、上述过程可表示为NaCl Na++Cl-5. 劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是
A、a为Na+ , b为Cl- B、水分子破坏了NaCl中的离子键 C、NaCl只有在水溶液中才能发生电离 D、上述过程可表示为NaCl Na++Cl-5. 劳动创造幸福未来。下列劳动项目与所述的化学知识关联不合理的是选项
劳动项目
化学知识
A
科学研究:燃煤脱硫
增大煤燃烧放出的热量
B
工厂生产:冶炼钢铁
涉及氧化还原反应
C
社会服务:推广使用免洗手酒精消毒液
酒精消毒液酒精能使蛋白质变性
D
家务劳动:饭后用热的纯碱溶液洗涤餐具
油脂在碱性条件下发生水解
A、A B、B C、C D、D6. 部分含氮物质的分类与相应化合价关系如图所示。下列说法正确的是( ) A、a的氧化或还原均可实现氮的固定 B、b是红棕色气体,b常温下可转化为c C、常温下d的稀溶液可保存在铝制容器中 D、e的溶液一定呈中性7. 化合物Q可用于合成药物,结构如图所示。下列有关说法正确的是
A、a的氧化或还原均可实现氮的固定 B、b是红棕色气体,b常温下可转化为c C、常温下d的稀溶液可保存在铝制容器中 D、e的溶液一定呈中性7. 化合物Q可用于合成药物,结构如图所示。下列有关说法正确的是 A、化合物Q中无手性碳原子 B、化合物Q中所有原子均处于同一平面 C、化合物Q苯环上的一溴代物有2种 D、1mol化合物Q最多能与3molH2加成8. 下列实验操作规范的是( )
A、化合物Q中无手性碳原子 B、化合物Q中所有原子均处于同一平面 C、化合物Q苯环上的一溴代物有2种 D、1mol化合物Q最多能与3molH2加成8. 下列实验操作规范的是( )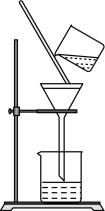
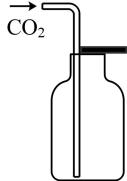
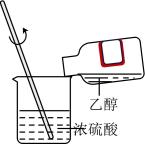
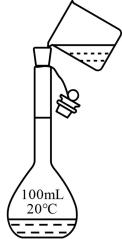
A.过滤
B.排空气法收集
C.混合浓硫酸和乙醇
D.溶液的转移
A、A B、B C、C D、D9. 下列物质性质实验对应的离子方程式书写正确的是( )A、金属钠加入水中: B、溶液中滴入过量NaOH溶液: C、同浓度同体积溶液与NaOH溶液混合: D、溶液中通入足量氯气:10. 臭氧层可阻止紫外线辐射,氟利昂(如CFCl3)破坏臭氧层的反应过程如图所示。下列说法正确的是 A、过程Ⅰ中断裂极性键C-F键 B、过程Ⅱ和Ⅲ中不涉及电子转移 C、臭氧被破坏的过程中Cl作催化剂 D、CFCl3的空间构型是正四面体形11. 我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气(CO和H2),原理如图所示,下列说法错误的是
A、过程Ⅰ中断裂极性键C-F键 B、过程Ⅱ和Ⅲ中不涉及电子转移 C、臭氧被破坏的过程中Cl作催化剂 D、CFCl3的空间构型是正四面体形11. 我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气(CO和H2),原理如图所示,下列说法错误的是 A、催化电极b与电源负极相连 B、电解时催化电极a附近的pH增大 C、电解时阴离子透过交换膜向a极迁移 D、生成合成气时电极上发生还原反应12. 已知物质的相关数据如下表,下列说法正确的是
A、催化电极b与电源负极相连 B、电解时催化电极a附近的pH增大 C、电解时阴离子透过交换膜向a极迁移 D、生成合成气时电极上发生还原反应12. 已知物质的相关数据如下表,下列说法正确的是物质
相关数据
A、不与盐酸溶液反应 B、溶液中存在的所有微粒有: C、与碳酸钠溶液反应,可能产生气体 D、向石灰水悬浊液中加入溶液,溶液可能变澄清二、非选择题
-
13. 铁、硒、铜都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:(1)、乙烷硒啉是一种抗癌新药,其结构如图:

①基态Se原子的核外电子排布式为[Ar]。
②该新药分子中有种不同化学环境的H原子。
③SeO的空间构型为。
(2)、富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
①基态Fe2+的价电子轨道表示式为。
②富马酸分子中σ键与π键的数目比为。
③富马酸亚铁中各元素的电负性由大到小的顺序为。
(3)、铜的某种氧化物的晶胞结构如图所示,若该晶胞中O原子之间的最近距离为apm,阿伏加德罗常数的值为NA , 则该晶胞的密度为g•cm-3(填含a、NA的代数式). 14. 色满结构单元(
14. 色满结构单元( )广泛存在于许多具有生物活性分子的结构中。一种含色满结构单元的药物中间体G的合成路线如图:
)广泛存在于许多具有生物活性分子的结构中。一种含色满结构单元的药物中间体G的合成路线如图: (1)、色满结构单元(
(1)、色满结构单元( )的分子式是。 (2)、乙酸酐的结构简式是
)的分子式是。 (2)、乙酸酐的结构简式是 , A→B反应类型是。 (3)、检验A中的含氧官能团的化学试剂是;写出G中含氧官能团的名称为。(4)、E→F的化学方程式是。(5)、乙二酸二乙酯由乙二酸和乙醇反应制得,乙二酸二乙酯的结构简式是。M是乙二酸二乙酯的同分异构体,写出两种满足下列条件的M的结构简式、。
, A→B反应类型是。 (3)、检验A中的含氧官能团的化学试剂是;写出G中含氧官能团的名称为。(4)、E→F的化学方程式是。(5)、乙二酸二乙酯由乙二酸和乙醇反应制得,乙二酸二乙酯的结构简式是。M是乙二酸二乙酯的同分异构体,写出两种满足下列条件的M的结构简式、。①1molM能与足量NaHCO3反应放出2molCO2
②核磁共振氢谱有三组峰
(6)、设计以 为原料制备
为原料制备 的合成路线(无机试剂任选)。 15. 我国自主开发的“钛战甲”是一种钛合金材料,为深潜万米的“奋斗者”号建造了世界最大、搭载人数最多的潜水器载人舱球壳。TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去):
的合成路线(无机试剂任选)。 15. 我国自主开发的“钛战甲”是一种钛合金材料,为深潜万米的“奋斗者”号建造了世界最大、搭载人数最多的潜水器载人舱球壳。TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去):
已知:
①TiO2+2C+2Cl2TiCl4+2CO
②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:
(1)、盛放浓盐酸的仪器名称为 , 圆底烧瓶内所装试剂可为(填编号)。①MnO2 ②KMnO4 ③浓H2SO4
写出其中发生的离子反应方程式。
(2)、装置的连接顺序为(D装置可重复使用)。(3)、对于实验过程的控制,开始的操作为(填①或②),实验结束的操作为(填③或④)。①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
(4)、装置C左边进气的细长导管作用为。(5)、吸收尾气中CO的的化学方程式。(6)、所得的TiCl4可用Mg制Ti,该过程可在气氛围保护下进行 (填编号) 。①氮气 ②氧气 ③水蒸气 ④氩气
16. 在我国大力推进生态文明建设,全力实现“碳达峰”、“碳中和”的时代背景下,对CH4和CO2利用的研究尤为重要。Ⅰ.我国科学家研发的水系可逆Zn-CO2电池可吸收利用CO2 , 将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的H2O解离成H+和OH- , 工作原理如图所示:
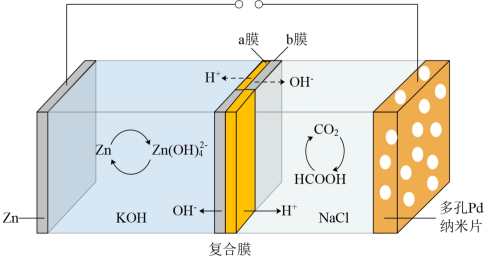 (1)、充电时复合膜中向Zn极移动的离子是 , 放电时负极的电极反应式为。
(1)、充电时复合膜中向Zn极移动的离子是 , 放电时负极的电极反应式为。Ⅱ.科学家使CH4和CO2发生重整反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247kJ•mol-1。生成合成气CO和H2 , 以实现CO2的循环利用。该反应中,如何减少积碳,是研究的热点之一。某条件下,发生主反应的同时,还发生了积碳反应:
CO岐化:2CO(g)CO2(g)+C(s) △H1=-172kJ•mol-1
CH4裂解:CH4(g)C(s)+2H2(g) △H2=+75kJ•mol-1
(2)、如图表示表示温度和压强对积碳反应平衡碳量的影响,其中表示对CO岐化反应中平衡碳量影响的是。(填“图a”或“图b”),理由是。 (3)、结合图分析,在700℃、100kPa的恒压密闭容器中进行此重整反应且达到平衡,当升高温度至1000℃达到平衡时,容器中的含碳量(填“减小”“不变”或“增大”),由此可推断100kPa且高温时积碳主要由(填“歧化”或“裂解”)反应产生。(4)、合成气CO和H2 , 可用于合成甲醇,能说明反应CO(g)+2H2(g)CH3OH(g)一定达平衡状态的是____(填字母)。A、CO的消耗速率等于CH3OH的生成速率 B、一定条件,CO的转化率不再变化 C、在绝热恒容的容器中,平衡常数不再变化 D、容器中气体的平均相对分子质量不再变化(5)、向1L恒容密闭容器中通入4mol的CH4和2mol的CO2 , 在800℃下若只发生主反应一段时间后达到平衡,测得CO的体积分数为25%,则主反应的K=(保留两位有效数字)。
(3)、结合图分析,在700℃、100kPa的恒压密闭容器中进行此重整反应且达到平衡,当升高温度至1000℃达到平衡时,容器中的含碳量(填“减小”“不变”或“增大”),由此可推断100kPa且高温时积碳主要由(填“歧化”或“裂解”)反应产生。(4)、合成气CO和H2 , 可用于合成甲醇,能说明反应CO(g)+2H2(g)CH3OH(g)一定达平衡状态的是____(填字母)。A、CO的消耗速率等于CH3OH的生成速率 B、一定条件,CO的转化率不再变化 C、在绝热恒容的容器中,平衡常数不再变化 D、容器中气体的平均相对分子质量不再变化(5)、向1L恒容密闭容器中通入4mol的CH4和2mol的CO2 , 在800℃下若只发生主反应一段时间后达到平衡,测得CO的体积分数为25%,则主反应的K=(保留两位有效数字)。