湖南省岳阳市2023年高三下学期教学质量监测(二模)化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 化学与生产、生活和科技密切相关。下列说法错误的是A、含氟牙膏能预防龋齿 B、北京冬奥会运动员“战袍”内层添加石墨烯片用于保暖,石墨烯和碳纳米管互为同分异构体 C、华为自主研发的“麒麟”芯片与太阳能电池感光板所用材料均为晶体硅 D、口罩的鼻梁条使用铝合金,利用其密度小、抗腐蚀性好的优点2. 掌握化学实验技能是进行科学探究的基本保证。下列有关说法正确的是
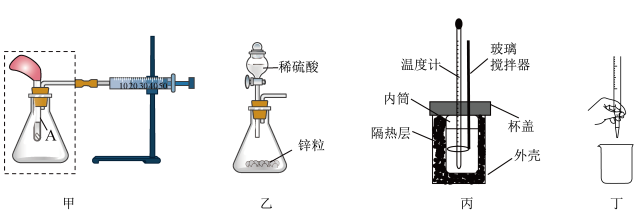 A、若将甲中注射器的活塞往右拉,能自动恢复到原位,说明甲装置气密性好 B、将甲虚线框中的装置换为乙装置,滴入稀硫酸后若注射器活塞右移,说明锌与硫酸反应为放热反应 C、用丙装置进行中和反应反应热的测定实验时,NaOH要缓慢倒入稀硫酸中 D、丁装置是排出碱式滴定管中的气泡操作3. 汽车尾气中的碳氢化物与臭氧反应是造成城市光化学污染的主要原因,其中常见的反应为 , 已知为阿伏加德罗常数的值,下列有关说法正确的是A、标准状况下,中所含极性共价健数目为 B、和均为只含非极性键的非极性分子 C、和分子中C原子采取杂化和杂化 D、若有参与反应,则反应中转移的电子数目为4. 下列解释事实的离子方程式正确的是A、实验室配制的亚铁盐溶液在空气中被氧化: B、漂白粉溶液在空气中失效: C、向硫酸铜溶液中加入NaHS溶液生成黑色沉淀: D、用做碘量法实验时,溶液pH不可太低,否则溶液变浑浊:5. 常用作沉淀滴定分析试剂。X是原子半径最小的元素,Y的基态原子中单电子与成对电子个数比为3∶4,Z元素的电负性仅次于氟元素,W原子电子总数与Z原子的最外层电子数相同。下列说法正确的是A、简单氢化物的稳定性: B、电负性: C、第一电离能: D、Y原子核外电子有7种空间运动状态6. Paxlovid是近期抗击新冠病毒的药物中较出名的一种,其主要成分奈玛特韦(Nirmatrelvir)合成工艺中的一步反应(反应条件已省略)如下图。下列说法错误的是
A、若将甲中注射器的活塞往右拉,能自动恢复到原位,说明甲装置气密性好 B、将甲虚线框中的装置换为乙装置,滴入稀硫酸后若注射器活塞右移,说明锌与硫酸反应为放热反应 C、用丙装置进行中和反应反应热的测定实验时,NaOH要缓慢倒入稀硫酸中 D、丁装置是排出碱式滴定管中的气泡操作3. 汽车尾气中的碳氢化物与臭氧反应是造成城市光化学污染的主要原因,其中常见的反应为 , 已知为阿伏加德罗常数的值,下列有关说法正确的是A、标准状况下,中所含极性共价健数目为 B、和均为只含非极性键的非极性分子 C、和分子中C原子采取杂化和杂化 D、若有参与反应,则反应中转移的电子数目为4. 下列解释事实的离子方程式正确的是A、实验室配制的亚铁盐溶液在空气中被氧化: B、漂白粉溶液在空气中失效: C、向硫酸铜溶液中加入NaHS溶液生成黑色沉淀: D、用做碘量法实验时,溶液pH不可太低,否则溶液变浑浊:5. 常用作沉淀滴定分析试剂。X是原子半径最小的元素,Y的基态原子中单电子与成对电子个数比为3∶4,Z元素的电负性仅次于氟元素,W原子电子总数与Z原子的最外层电子数相同。下列说法正确的是A、简单氢化物的稳定性: B、电负性: C、第一电离能: D、Y原子核外电子有7种空间运动状态6. Paxlovid是近期抗击新冠病毒的药物中较出名的一种,其主要成分奈玛特韦(Nirmatrelvir)合成工艺中的一步反应(反应条件已省略)如下图。下列说法错误的是 A、化合物a、b能溶于水与氢键有关 B、化合物a和b均含有3种官能团 C、化合物a分子中含2个手性碳 D、1mol b最多能与6 mol的NaOH溶液反应7. 部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是
A、化合物a、b能溶于水与氢键有关 B、化合物a和b均含有3种官能团 C、化合物a分子中含2个手性碳 D、1mol b最多能与6 mol的NaOH溶液反应7. 部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是 A、a溶液放置在空气中一段时间会出现浑浊现象 B、空气中燃烧b可以得到大量的d C、e的浓溶液可以用铁槽车运输是利用其强氧化性 D、b附着在试管壁上可以用二硫化碳或热的浓NaOH溶液洗涤8. 某小组探究的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后,④中产生白烟。下列分析正确的是
A、a溶液放置在空气中一段时间会出现浑浊现象 B、空气中燃烧b可以得到大量的d C、e的浓溶液可以用铁槽车运输是利用其强氧化性 D、b附着在试管壁上可以用二硫化碳或热的浓NaOH溶液洗涤8. 某小组探究的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后,④中产生白烟。下列分析正确的是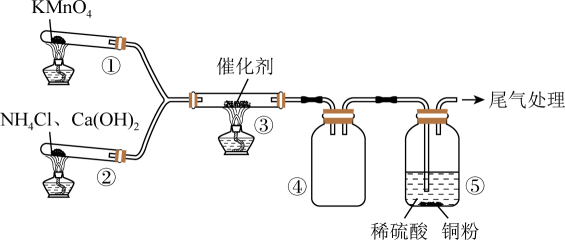 A、②中能用替代 B、③、④中现象说明③中的反应是 C、④中白烟的主要成分是 D、反应结束后若⑤中溶液变蓝则溶液中一定含有9. 实验室以二氧化铺铈废渣为原料制备 , 其部分实验过程如下:
A、②中能用替代 B、③、④中现象说明③中的反应是 C、④中白烟的主要成分是 D、反应结束后若⑤中溶液变蓝则溶液中一定含有9. 实验室以二氧化铺铈废渣为原料制备 , 其部分实验过程如下:
已知:能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:(水层)(有机层)(有机层)(水层)。下列说法正确的是
A、“酸浸”过程中做氧化剂 B、加氨水“中和”除去过量盐酸,主要目的是提高的萃取率 C、试剂a一定是盐酸 D、“沉淀”时反应的离子方程式为10. 某水性钠离子电池电极材料由、、、组成,其立方晶胞嵌入和嵌出过程中,与含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是 A、普鲁士蓝中与个数比为1∶2 B、格林绿晶体中周围等距且最近的数为6 C、基态Fe原子的价电子排布式为 , 失去4s电子转化为 D、若普鲁士白的晶胞棱长为apm,则其晶体的密度为11. 科学家研发了一种绿色环保“全氢电池”,某化学兴趣小组将其用于铜片上镀银作为奖牌奖给优秀学生,工作原理如图所示。下列说法错误的是
A、普鲁士蓝中与个数比为1∶2 B、格林绿晶体中周围等距且最近的数为6 C、基态Fe原子的价电子排布式为 , 失去4s电子转化为 D、若普鲁士白的晶胞棱长为apm,则其晶体的密度为11. 科学家研发了一种绿色环保“全氢电池”,某化学兴趣小组将其用于铜片上镀银作为奖牌奖给优秀学生,工作原理如图所示。下列说法错误的是 A、负极的电极反应式: B、当吸附层a通入2.24L(标况)氢气时,溶液中有0.2mol离子透过交换膜 C、离子交换膜既可以是阳离子交换膜也可以是阴离子交换膜 D、电池工作时,m电极质量逐渐增重12. 催化丙烯制醛的反应机理如图所示。下列说法错误的是
A、负极的电极反应式: B、当吸附层a通入2.24L(标况)氢气时,溶液中有0.2mol离子透过交换膜 C、离子交换膜既可以是阳离子交换膜也可以是阴离子交换膜 D、电池工作时,m电极质量逐渐增重12. 催化丙烯制醛的反应机理如图所示。下列说法错误的是 A、该反应的催化剂为 B、上述循环过程中,Co的化学键数目发生了变化 C、若反应物为乙烯,产物一定为 D、总反应式为13. 时,含等浓度的与的混合溶液中发生反应: , 时刻,改变某一外界条件维续反应至时刻,溶液中和随时间的变化关系如图所示。下列说法正确的是
A、该反应的催化剂为 B、上述循环过程中,Co的化学键数目发生了变化 C、若反应物为乙烯,产物一定为 D、总反应式为13. 时,含等浓度的与的混合溶液中发生反应: , 时刻,改变某一外界条件维续反应至时刻,溶液中和随时间的变化关系如图所示。下列说法正确的是已知:时,该反应的化学平衡常数
 A、若时刻未改变外界条件,则此时该反应: B、若时刻反应达到平衡,则时刻改变的条件可能为及时移除Ag C、若始终保持温度不变,则逆反应速率: D、内的平均反应速率为14. 常温下,向的溶液中以恒定的速率滴加稀盐酸,测得溶液pH随时间的变化如图所示。下列有关叙述错误的是
A、若时刻未改变外界条件,则此时该反应: B、若时刻反应达到平衡,则时刻改变的条件可能为及时移除Ag C、若始终保持温度不变,则逆反应速率: D、内的平均反应速率为14. 常温下,向的溶液中以恒定的速率滴加稀盐酸,测得溶液pH随时间的变化如图所示。下列有关叙述错误的是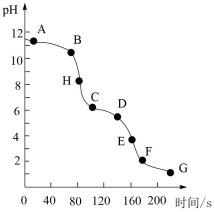 A、溶液中水的电离程度: B、B点对应的溶液满足关系: C、CD段主要发生的反应为: D、H点对应的溶液满足关系:
A、溶液中水的电离程度: B、B点对应的溶液满足关系: C、CD段主要发生的反应为: D、H点对应的溶液满足关系:二、非选择题
-
15. 氧化二氯是国际公认的高效安全灭菌消毒剂之一,某学习小组以为原料用下列装置制备次氯酸溶液。

已知:常温常压下,沸点为3.8℃,42℃以上会分解生成和 , 易溶于水并与水立即反应生成HClO。将氯气和空气(不参与反应)通入足量含水8%的碳酸钠溶液中发生反应,然后用水吸收产生的气体(不含)可制得次氯酸溶液。
(1)、HClO分子的VSEPR模型(价层电子对互模型)名称为(2)、各装置的连接顺序为A→→→→(3)、写出B中反应的化学方程式(4)、装置E中采用棕色圆底烧瓶的原因(5)、此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答一条即可)(6)、用下列实验方案测定所得溶液中次氯酸的物质的量浓度:量取10.00 mL上述次氯酸溶液,并稀释至100.00 mL,再从其中取出10.00 mL于锥形瓶中,加入足量KI溶液,滴加几滴淀粉溶液,用标准溶液滴定至终点,消耗25.00 mL标准溶液。该溶液中为(保留两位小数)。(已知涉及的反应为 , )(7)、滴定过程中滴定前读数正确,滴定后仰视读数,则测得结果会(填“偏高”、“偏低”或“无影响”)。16. 硼氢化钠()广泛用于化工生产,常温下能与水反应,碱性条件下能稳定存在,易溶于异丙胺(沸点为33℃)。工业上可用硼镁矿(主要成分为 , 含少量杂质)制取 , 其工艺流程如图1所示。
回答下列问题:
(1)、中含有的化学键为(2)、Ti的核外电子排布式(3)、碱溶过滤得滤渣的主要成分是、(4)、写出制取的化学方程式(5)、高温合成中,加料之前需将反应器加热至100℃以上,并通入氩气。通入氩气的目的是(6)、在碱性条件下,用惰性电极电解溶液也可制得 , 装置如图2所示,写出阴极反应的电极方程式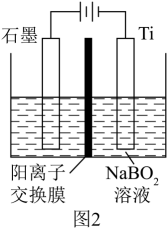 (7)、常用作还原剂,也是常见的还原剂。与相同氧化剂反应时,的还原能力相当于的还原能力。17. 合成氨反应是目前最有效的工业固氮方法,解决数亿人口生存问题。(1)、反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。
(7)、常用作还原剂,也是常见的还原剂。与相同氧化剂反应时,的还原能力相当于的还原能力。17. 合成氨反应是目前最有效的工业固氮方法,解决数亿人口生存问题。(1)、反应历程中各步势能变化如图所示,其中吸附在催化剂表面的物种用*标注。
该历程中反应速率最慢的步骤的方程式为
(2)、在、压强为0.9MPa条件下,向一恒压密闭容器中通入的混合气体,体系中各气体的含量与时间变化关系如图所示:
①以下叙述不能说明该条件下反应达到平衡状态的是(填字母)。
a.氨气的体积分数保持不变
b.容器中保持不变
c.气体平均相对分子质量保持不变
d.气体密度保持不变
e.
②反应20min时达到平衡,则0~20min内 , 该反应的(保留小数点后两位)。(为以分压表示的平衡常数)
③若起始条件相同,在恒容容器中发生反应,则达到平衡时的含量符合图中点(填“d”“e”“f”或“g”)。
(3)、氨化脱硝过程发生反应 , 分析420℃的脱硝效率低于390℃的脱硝效率可能的原因 (4)、25℃用甲酸吸收氨气可得到溶液。已知:25℃时甲酸的 , 的。则反应的平衡常数。18. 聚氨酯材料是一种新兴的有机高分子材料,被誉为“第五大塑料”,因其卓越的性能而被广泛应用于国民经济众多领域。I是工业合成聚氨酯的初级反应中得到的一种低聚物。
(4)、25℃用甲酸吸收氨气可得到溶液。已知:25℃时甲酸的 , 的。则反应的平衡常数。18. 聚氨酯材料是一种新兴的有机高分子材料,被誉为“第五大塑料”,因其卓越的性能而被广泛应用于国民经济众多领域。I是工业合成聚氨酯的初级反应中得到的一种低聚物。 (1)、A的名称是 , C生成D的反应类型为(2)、B中所含官能团的名称是、(3)、写出A转化为B时生成的反式结构产物的结构简式(4)、写出生成I的化学方程式(5)、E与浓硝酸、浓硫酸反应时还会生成、J有多种同分异构体,同时满足下列条件的有种
(1)、A的名称是 , C生成D的反应类型为(2)、B中所含官能团的名称是、(3)、写出A转化为B时生成的反式结构产物的结构简式(4)、写出生成I的化学方程式(5)、E与浓硝酸、浓硫酸反应时还会生成、J有多种同分异构体,同时满足下列条件的有种(a)含有一个苯环 (b)能发生银镜反应 (c)红外光谱显示没有氮氧键
其中核磁共振氢谱显示有四组峰,峰面积之比为2∶2∶2∶1的结构简式为
(6)、合成聚氨酯的反应比较复杂,包括初级反应和次级反应。初级反应包括预聚反应和扩链反应。预聚反应得到低聚物I,扩链反应生成取代脲基,可表示如下:
设计以
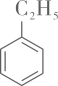 为原料(无机物任选)合成
为原料(无机物任选)合成 的合成路线
的合成路线