北京市房山区2023年高三一模考试化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 聚醚醚酮(PEEK)是一种高分子材料,可用于3D打印,其结构简式如图所示。

下列关于该物质的说法正确的是
A、属于纯净物 B、分子中存在极性键 C、分子呈直线型 D、能够发生水解反应2. 下列化学用语或图示表达错误的是A、的结构式: B、NaOH的电子式: C、的VSEPR模型:
C、的VSEPR模型: D、的空间结构模型:
D、的空间结构模型: 3. 在考古研究中,通过分析铜器中(铅)同位素的比值,可以推断铜器是否同源。下列说法错误的是A、Pb是第五周期元素 B、含有中子数为122 C、可用质谱法区分和 D、Pb的原子半径比Ge大4. 设为阿伏加德罗常数的值。下列说法正确的是A、28 g 分子中含有的σ键数目为 B、标准状况下,22.4 L HCl气体中数目为 C、的溶液中OH-数目为 D、2.3 g钠与足量氯气反应,电子转移的数目为5. 下列关于物质保存的解释,反应方程式错误的是A、溶液中放入铁粉: B、浓硝酸保存于棕色试剂瓶: C、氮肥保存于阴凉处: D、金属钠保存于煤油中:6. 如图所示的装置中,烧瓶中充满干燥气体a,打开弹簧夹c,将滴管中的液体b挤入烧瓶内,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
3. 在考古研究中,通过分析铜器中(铅)同位素的比值,可以推断铜器是否同源。下列说法错误的是A、Pb是第五周期元素 B、含有中子数为122 C、可用质谱法区分和 D、Pb的原子半径比Ge大4. 设为阿伏加德罗常数的值。下列说法正确的是A、28 g 分子中含有的σ键数目为 B、标准状况下,22.4 L HCl气体中数目为 C、的溶液中OH-数目为 D、2.3 g钠与足量氯气反应,电子转移的数目为5. 下列关于物质保存的解释,反应方程式错误的是A、溶液中放入铁粉: B、浓硝酸保存于棕色试剂瓶: C、氮肥保存于阴凉处: D、金属钠保存于煤油中:6. 如图所示的装置中,烧瓶中充满干燥气体a,打开弹簧夹c,将滴管中的液体b挤入烧瓶内,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
a(干燥气体)
b(液体)
A
水
B
水
C
饱和溶液
D
溴的水溶液
A、A B、B C、C D、D7. 下列实验方案(图中部分夹持略),不能达到实验目的的是选项
A
B
C
D
目的
制取无水固体
检验产生的
证明
探究化学反应速率的影响因素
实验方案



 A、A B、B C、C D、D8. 有氧条件下,在Fe基催化剂表面,还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法错误的是
A、A B、B C、C D、D8. 有氧条件下,在Fe基催化剂表面,还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法错误的是 A、在酸性配位点上,与通过配位键形成 B、增大压强有利于NO与吸附在配位点上形成 C、在反应过程中,Fe基可以提高NO的转化率 D、该反应的总方程式为:9. 钛酸钙是典型的钙钛矿型化合物,该类化合物具有特殊的理化性质,比如吸光性、电催化性等,其晶体结构如图所示。
A、在酸性配位点上,与通过配位键形成 B、增大压强有利于NO与吸附在配位点上形成 C、在反应过程中,Fe基可以提高NO的转化率 D、该反应的总方程式为:9. 钛酸钙是典型的钙钛矿型化合物,该类化合物具有特殊的理化性质,比如吸光性、电催化性等,其晶体结构如图所示。
下列说法错误的是
A、该晶体为离子晶体 B、钛酸钙的化学式为 C、每个晶胞中含有8个 D、每个Ca²⁺周围距离最近且等距的有12个10. BAS是一种可定向运动的“分子机器”,其合成路线如下:
下列说法正确的是
A、 存在顺反异构
B、
存在顺反异构
B、 既有酸性又有碱性
C、中间产物的结构简式为
既有酸性又有碱性
C、中间产物的结构简式为 D、①为加成反应,②为消去反应
11. 某温度下,将pH和体积均相同的HCl和溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述错误的是
D、①为加成反应,②为消去反应
11. 某温度下,将pH和体积均相同的HCl和溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述错误的是 A、稀释前溶液的浓度: B、溶液中水的电离程度:b点<c点 C、从b点到d点,溶液中逐渐增大 D、在d点和e点均存在:(酸根阴离子)12. 某种培根型碱性氢氧燃料电池示意图如所示,下列有关该电池的说法错误的是
A、稀释前溶液的浓度: B、溶液中水的电离程度:b点<c点 C、从b点到d点,溶液中逐渐增大 D、在d点和e点均存在:(酸根阴离子)12. 某种培根型碱性氢氧燃料电池示意图如所示,下列有关该电池的说法错误的是 A、电池放电时,向镍电极Ⅰ的方向迁移 B、正极电极反应为: C、出口Ⅰ处有水生成 D、循环泵可使电解质溶液不断浓缩、循环13. 锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一,下图为以和作为电极氧化还原电对的碱性锌铁液流电池放电时工作原理示意图。
A、电池放电时,向镍电极Ⅰ的方向迁移 B、正极电极反应为: C、出口Ⅰ处有水生成 D、循环泵可使电解质溶液不断浓缩、循环13. 锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一,下图为以和作为电极氧化还原电对的碱性锌铁液流电池放电时工作原理示意图。
下列说法错误的是
A、放电过程中,左侧池中溶液pH逐渐减小 B、放电过程中,总反应为 C、充电过程中,阴极的电极反应为 D、充电过程中,当2 mol 通过PBI膜时,导线中通过1 mol14. 室温下,向新制酸化的和未酸化的0.1 mol·L-1的FeSO4溶液中通入氧气且搅拌时,pH变化曲线如图。
已知:Fe(OH)3的;Fe(OH)2的;Fe3+开始沉淀时的pH≈1.5;Fe2+开始沉淀时的pH≈6.3
下列说法错误的是
A、M点对应的溶液中Fe2+水解程度小于P点对应的溶液中Fe2+水解程度 B、导致M点→N点pH升高的反应为: C、导致P点→Q点pH降低的反应为: D、O点和Q点后,Fe2+全部转化为Fe(OH)3 , 不再发生Fe2+的氧化反应二、非选择题
-
15. 邻羟基苯甲酸俗称水杨酸,具有抗炎、抗菌、角质调节等作用。其分子结构如图所示。
 (1)、邻羟基苯甲酸中碳原子的杂化方式为。(2)、下列关于邻羟基苯甲酸的说法合理的是。
(1)、邻羟基苯甲酸中碳原子的杂化方式为。(2)、下列关于邻羟基苯甲酸的说法合理的是。a.属于分子晶体
b.沸点高于对羟基苯甲酸
c.相同条件下,在水中的溶解度小于对羟基苯甲酸
(3)、具有酚羟基的物质通常能与氯化铁溶液发生显色反应。其显色原理是苯酚电离出的和形成配位键,得到的显紫色。①基态的价电子排布式为。
②实验发现对羟基苯甲酸不能与氯化铁发生显色反应,试从化学平衡的角度解释其原因是。
(4)、理论上可以通过乙酸和邻羟基苯甲酸反应制备阿司匹林 ,然而实际生产中该反应产率极低。已知:
,然而实际生产中该反应产率极低。已知:i.乙醇和乙酸在酸性条件下发生酯化反应,部分反应机理:

ii.苯酚中O原子2p轨道与C原子2p轨道平行,O原子p轨道电子云与苯环大π键电子云发生重叠,电子向苯环转移,降低了氧原子周围的电子云密度。
①比较O、C电负性大小,并从原子结构角度解释两元素电负性差异的原因是。
②请结合已知信息,分析以邻羟基苯甲酸和乙酸为原料制备阿司匹林产率偏低的原因是。
16. 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。(1)、Ⅰ.制取氢气甲醇和水蒸气制取氢气的过程中有下列反应:
kJ·mol
kJ·mol
写出以甲醇为原料制取氢气的热化学方程式。
(2)、理论上,能提高平衡产率的措施有(写出一条即可)。(3)、Ⅱ.储存氢气硼氢化钠()是研究最广泛的储氢材料之一
已知:
i.B的电负性为2.0,H的电负性为2.1
ii.25℃下在水中的溶解度为55 g,在水中的溶解度为0.28 g
在配制溶液时,为了防止发生水解反应,可以加入少量的(填写化学式)。
(4)、向水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠()和氢气。写出该反应的化学方程式。(5)、在研究浓度对催化剂Ru/NGR活性的影响时,发现B点后(见图1)增加的浓度,制氢速率反而下降,推断可能的原因是。 (6)、用惰性电极电解溶液可制得 , 实现物质的循环使用,制备装置如图2所示。
(6)、用惰性电极电解溶液可制得 , 实现物质的循环使用,制备装置如图2所示。
①钛电极的电极反应式是。
②电解过程中,阴极区溶液pH(填“增大”“减小”或“不变”)
17. 葛根素具有广泛的药理作用,临床上主要用于心脑血管疾病的治疗,其一种合成路线如下图:
已知:
ⅰ.BnBr为

ⅱ.

ⅲ.

ⅳ.
 (1)、A中含氧官能团为。(2)、由B到C所发生的化学反应方程式为。(3)、试剂2的结构简式是。(4)、E分子中含有3个六元环,下列描述正确的是。
(1)、A中含氧官能团为。(2)、由B到C所发生的化学反应方程式为。(3)、试剂2的结构简式是。(4)、E分子中含有3个六元环,下列描述正确的是。a.E分子中存在手性碳原子
b.E分子中存在2种含氧官能团
c.1 mol E与溴水反应最多可消耗4 mol
(5)、已知G分子中有六元环状结构,它的一种同分异构体含有五元环,且其官能团的种类和个数与G相同,请写出该同分异构体的结构简式;(6)、反应2的化学反应方程式为;(7)、在有机合成反应时,往往需要先将要保护的基团“反应掉”,待条件适宜时,再将其“复原”,这叫做“基团保护”。上述反应中起基团保护作用的是(填选项)。a.反应1和反应3 b.反应4和反应5 c.反应2和反应6
18. 高纯氯化锰 在电子技术和精细化工领域有重要应用。一种由粗锰粉(含磷酸盐、硅酸盐、铁、铅等)制备高纯氯化锰的工艺流程如下(部分操作和条件略)。Ⅰ.将粗锰粉加入盐酸中充分反应,再加入NaOH溶液调节pH=6,过滤;
Ⅱ.向Ⅰ所得滤液中加入 酸性溶液,充分反应后加入 调节 ,过滤;
Ⅲ.向Ⅱ所得滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
Ⅳ.浓缩、结晶、分离、干燥,得到产品
(1)、氯化锰中锰元素的化合价是。(2)、步骤Ⅰ中去除了磷酸盐和硅酸盐,且对磷酸盐的去除效果比硅酸盐好,这与酸性 有关。从原子结构角度解释酸性 原因:。(3)、步骤Ⅰ所得滤液中的金属离子主要含有 、 和 等,且 不被 氧化。已知:生成氢氧化物沉淀的pH
开始沉淀时
6.5
1.5
8.1
6.5
完全沉淀时
8.3
2.8
10.1
8.5
注:金属离子的起始浓度为0.1mol/L
①结合表中数据,解释步骤Ⅱ中加入 酸性溶液的目的:。
②配平加入 后发生反应的离子方程式: ,
(4)、步骤Ⅲ的目的是去除 : 。推测溶解度:PbSMnS(填“>”、“<”或“=”)。(5)、已知:氯化锰的溶解度随温度的变化如图。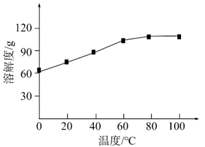
步骤Ⅲ所得滤液中仍含有少量易溶杂质,补充步骤Ⅳ浓缩、结晶的操作:将滤液 , 析出晶体后过滤。重复操作2~3次,收集晶体。
19. 某小组同学用二氧化锰与过量浓盐酸反应制备氯气过程中(装置如图所示)发现,二氧化锰仍有剩余时就观察到反应停止,对此现象开展探究。 (1)、二氧化锰与浓盐酸反应制备氯气的化学方程式是。(2)、[提出猜想]ⅰ.随着反应进行,c(Cl-)降低,不能被二氧化锰氧化
(1)、二氧化锰与浓盐酸反应制备氯气的化学方程式是。(2)、[提出猜想]ⅰ.随着反应进行,c(Cl-)降低,不能被二氧化锰氧化ⅱ.随着反应进行,……
[进行实验]将反应后的固液混合物倒出,平均分在2个试管中,分别进行以下实验,证实了猜想ⅰ不成立。
序号
实验操作
实验现象
Ⅰ
将湿润的淀粉碘化钾试纸放置于试管口,加热试管; , 充分振荡,继续加热
试纸未变蓝
Ⅱ
将湿润的淀粉碘化钾试纸放置于试管口,加热试管;滴入2滴浓硫酸,充分振荡,继续加热
滴入浓硫酸前,试纸不变蓝;滴入浓硫酸后,试纸变蓝
将Ⅰ中操作补充完整:
(3)、II中试纸变蓝说明试管中的反应产生了(填化学式)。(4)、[进一步实验]设计如下实验进一步探究。序号
实验装置
实验操作
现象
Ⅲ

向左侧烧杯中滴加2滴浓硫酸
滴加浓硫酸前,电流表指针不偏转;滴加浓硫酸后,电流表指针偏转
Ⅳ
向右侧烧杯中滴加2滴浓硫酸
电流表指针始终不偏转
滴加浓硫酸后,左边烧杯中反应的电极反应式是。
(5)、依据实验Ⅰ-Ⅳ,解释“二氧化锰仍有剩余时就观察到反应停止”的原因是。(6)、[新的探究]小组同学又进行了实验Ⅴ、Ⅵ。序号
实验操作
实验现象
Ⅴ
在0.5g二氧化锰中加入2毫升5%双氧水
产生气泡
Ⅵ
在0.5g二氧化锰中滴加2滴浓硫酸,再加入2毫升5%双氧水
产生气泡,黑色固体消失,生成无色溶液
Ⅵ中反应的离子方程式是。
(7)、结合依据实验Ⅰ-Ⅳ得出的结论,解释Ⅴ、Ⅵ中现象不同的原因。