北京市朝阳区2023年高三一模考试化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 我国科研人员首次以为原料合成了葡萄糖和长链脂肪酸,这项突破为人工和半人工合成“粮食”提供了新技术。合成路线如下:
CO葡萄糖、脂肪酸
下列说法错误的是
A、过程①、②中电能转化为化学能 B、葡萄糖分子中含有醛基、羟基 C、和互为同系物 D、葡萄糖不能发生水解反应2. 下列化学用语或图示表达正确的是A、HClO的电子式: B、中子数为1的氢原子:
C、NaCl的晶胞:
B、中子数为1的氢原子:
C、NaCl的晶胞: D、反-2-丁烯的结构简式:
D、反-2-丁烯的结构简式: 3. 和S均属于VIA族元素。下列关于Se及其化合物性质的比较错误的是A、第一电离能: B、原子半径:Se<As C、还原性: D、沸点:4. 我国科学家预言的T-碳已被合成。T-碳的晶体结构可看做将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,T-碳和金刚石的晶胞如图所示。下列说法错误的是
3. 和S均属于VIA族元素。下列关于Se及其化合物性质的比较错误的是A、第一电离能: B、原子半径:Se<As C、还原性: D、沸点:4. 我国科学家预言的T-碳已被合成。T-碳的晶体结构可看做将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,T-碳和金刚石的晶胞如图所示。下列说法错误的是 A、T-碳与金刚石互为同素异形体 B、T-碳与金刚石均属于共价晶体 C、T-碳与金刚石中键角均为 D、T-碳晶胞中平均含有32个碳原子5. 下列关于铜腐蚀的说法及方程式书写正确的是A、铜在潮湿空气中被腐蚀: B、铜在环境中被腐蚀: C、浓度越大,腐蚀反应速率越大 D、利用对铜的腐蚀制作印刷线路板:6. 用圆底烧瓶收集后进行喷泉实验。下列说法错误的是
A、T-碳与金刚石互为同素异形体 B、T-碳与金刚石均属于共价晶体 C、T-碳与金刚石中键角均为 D、T-碳晶胞中平均含有32个碳原子5. 下列关于铜腐蚀的说法及方程式书写正确的是A、铜在潮湿空气中被腐蚀: B、铜在环境中被腐蚀: C、浓度越大,腐蚀反应速率越大 D、利用对铜的腐蚀制作印刷线路板:6. 用圆底烧瓶收集后进行喷泉实验。下列说法错误的是 A、和都是极性分子 B、和分子中的共价键都是键 C、分子的键角小于分子的键角 D、烧瓶中溶液颜色变红的原因:7. 化学在国防领域发挥着重要作用。关于下列装备涉及材料的说法错误的是
A、和都是极性分子 B、和分子中的共价键都是键 C、分子的键角小于分子的键角 D、烧瓶中溶液颜色变红的原因:7. 化学在国防领域发挥着重要作用。关于下列装备涉及材料的说法错误的是A
防弹衣的主要材料:

两种单体的核磁共振氢谱峰数、峰面积均相同
B
隐形飞机的微波吸收材料:

单体能使溴水褪色
C
潜艇的消声瓦:

可由和
 合成
合成D
潜艇的耐压球壳:钛合金
钛合金中存在金属键
A、A B、B C、C D、D8. 将铜棒插入浓、稀溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓溶液的铜棒变粗。下列说法错误的是 A、铜棒变粗的反应: B、导线中电子移动的方向:b→a C、随着反应的进行,浓、稀溶液的浓度逐渐接近 D、的氧化性随增大而增强,Cu的还原性随增大而减弱9. 分析化学中以为指示剂,用标准溶液滴定溶液中的 , 测定。
A、铜棒变粗的反应: B、导线中电子移动的方向:b→a C、随着反应的进行,浓、稀溶液的浓度逐渐接近 D、的氧化性随增大而增强,Cu的还原性随增大而减弱9. 分析化学中以为指示剂,用标准溶液滴定溶液中的 , 测定。已知:i.溶液中存在平衡:
ii.25℃时,(砖红色),(白色)
下列分析错误的是
A、实验中先产生白色沉淀,滴定终点时产生砖红色沉淀 B、产生白色沉淀时,存在 C、当产生砖红色沉淀时,如果 , 已沉淀完全 D、滴定时应控制溶液pH在合适范围内,若pH过低,会导致测定结果偏低10. 冠醚能与碱金属离子结合(如下图所示),是有机反应很好的催化剂,如能加快与环己烯的反应速率。
用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大,两者结合能力越强。


下列说法错误的是
A、推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关 B、如图所示的实验中:①>②>③ C、冠醚通过与结合将携带进入有机相,从而加快反应速率 D、为加快与环己烯的反应速率,选择冠醚A比冠醚B更合适11. 瓜环[n](n=5,6,7,8…)是一种具有大杯空腔、两端开口的化合物(结构如图),在分子开关、催化剂、药物载体等方面有广泛应用。瓜环[n]可由 和HCHO在一定条件下合成。
和HCHO在一定条件下合成。
下列说法错误的是
A、合成瓜环的两种单体中分别含有酰胺基和醛基 B、 分子间可能存在不同类型的氢键
C、生成瓜环[n]的反应中,有键断裂
D、合成1mol瓜环[7]时,有7mol水生成
12. 向体积为1L的密闭容器中充入一定量 , 发生反应:
分子间可能存在不同类型的氢键
C、生成瓜环[n]的反应中,有键断裂
D、合成1mol瓜环[7]时,有7mol水生成
12. 向体积为1L的密闭容器中充入一定量 , 发生反应:编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
I
0.40
0.16
0.16
II
0.20
0.09
0.09
下列说法错误的是
A、 B、℃,该反应的平衡常数K=4 C、II中存在: D、℃时,向该容器中充入物质的量均为0.2mol的3种气体,反应将逆向进行13. 常温下,将4.0g铁钉加入到30mL4%的溶液中,一段时间后观察到铁钉表面产生气泡,氧气含量和溶液pH变化如下图所示。
下列说法错误的是
A、溶液pH<7的原因: B、铁钉表面产生气泡的原因: C、加入铁钉消耗 , 水解平衡正向移动,产生沉淀 D、推测溶液pH减小的原因:14. 化学链甲烷干重整联合制氢部分工艺的原理如图所示:
将1mol和充入干重整反应器,发生:
重整反应:
积炭反应:
研究发现,增大n(FeO)能减少积炭,并增大的值。下列说法错误的是
A、X的化学式为 , 被还原后可循环利用 B、增大n(FeO)能增大 , 推测发生 C、减少n(FeO),Fe上的积炭会导致蒸汽反应器中产生的纯度降低 D、干重整反应器中存在:二、非选择题
-
15. 是一种锂离子电池的正极材料,放电时生成。(1)、下列电子排布图表示的Li原子的状态中,能量最高的为(填序号)。
a.
 b.
b. c.
c. (2)、从价电子排布的角度解释Fe位于元素周期表d区的原因:。(3)、的制备:
(2)、从价电子排布的角度解释Fe位于元素周期表d区的原因:。(3)、的制备:的结构如图1所示。

①和之间的作用力类型为。
②的大于的 , 从结构角度解释原因:。
(4)、锂离子电池充放电过程中,正极材料晶胞的组成变化如图2所示。
①由于的空间构型为 , 且磷氧键键能较大,锂离子嵌入和脱出时,磷酸铁锂的空间骨架不易发生形变,具有良好的循环稳定性。
②正极材料在和之间转化时,经过中间产物。转化为的过程中,每摩晶胞转移电子的物质的量为摩。
16. 从低品位铜镍矿(含有、FeO、MgO、CuO等杂质)资源中提取镍和铜的一种工艺流程如下:
资料:一些物质的(25℃)如下。
物质
(1)、上述流程中,加快反应速率的措施是。(2)、浸出过程中通入的目的是。(3)、萃取时发生反应:(HR、在有机层,、在水层)。①某种HR的结构简式为
 ,该分子中可能与形成配位键的,原子有。
,该分子中可能与形成配位键的,原子有。②解释反萃取时的作用:。
(4)、黄钠铁矾[]比更易形成沉淀。反应终点pH与、沉淀率的关系如下表。反应终点pH
沉淀率/%
1.5
94.04
0.19
2.5
99.21
0.56
3.8
99.91
3.31
①生成黄钠铁矾的离子方程式是。
②沉淀时最适宜选用的反应终点pH是。
(5)、第二次使用MgO调节pH使沉淀完全,宜将pH调节至(填序号)。a.6~7 b.9~10 c.11~12
三、有机推断题
-
17. 氟唑菌酰羟胺是新一代琥珀酸脱氢酶抑制剂类杀菌剂,合成路线如下:

已知:i.
 (1)、A能与溶液反应产生。A的官能团有。(2)、A的某种同分异构体与A含有相同官能团,其核磁共振氢谱也有两组峰,结构简式为。(3)、B→D的化学方程式是。(4)、G的结构简式为。(5)、推测J→K的过程中,反应物的作用是。(6)、
(1)、A能与溶液反应产生。A的官能团有。(2)、A的某种同分异构体与A含有相同官能团,其核磁共振氢谱也有两组峰,结构简式为。(3)、B→D的化学方程式是。(4)、G的结构简式为。(5)、推测J→K的过程中,反应物的作用是。(6)、 可通过如下路线合成:
可通过如下路线合成:
已知:ii.R-O-R'+H2OROH+R'OH
iii.

①反应I的化学方程式为。
②M的结构简式为。
③设计步骤I和IV的目的是。
18. 工业烟气中常含有(NO、)。用NaClO溶液将氧化为 , 实现烟气中的脱除。(1)、在大气中会形成酸雨。形成酸雨的过程中,NO表现性。(2)、向NaClO溶液中加入硫酸,研究初始pH对脱除率的影响,结果如下。
已知:
①不用盐酸调节NaClO溶液初始pH的原因是。
②将pH=3.5时NaClO溶液脱除NO的离子方程式补充完整:。
□NO+□ +□ □□□
③pH<5.5时,分析脱除率随溶液初始pH升高而增大的可能原因:。
(3)、用分别将脱除前后的全部转化为 , 并用库仑仪测定的量,可计算脱除率。库仑仪工作的原理和装置如下:
检测前,电解质溶液中的保持定值时,电解池不工作。进入电解池后与反应,库仑仪便立即自动进行电解到又回到原定值,测定结束。通过测定电解消耗的电量可以求出的物质的量。
①在电解池中被还原为NO的离子方程式为。
②将脱除前、后等体积的烟气分别用上述装置进行测定,电解时转移电子的物质的量分别为amol、bmol。脱除率是。
③测量结束后,电解池中还检测到少量和 , 这将导致测定结果(填“偏高”或“偏低”),需进行校正。
19. 某小组同学探究与溶液的反应,实验如下。资料:i.(黄色)
ii.呈绿色(酸性条件下不稳定)、低浓度呈无色、MnS为肉色沉淀。
iii.
实验Ⅰ:
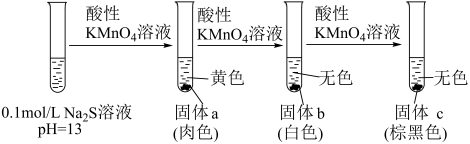 (1)、用离子方程式表示溶液显碱性的原因:。(2)、将固体a过滤、洗涤,放置在空气中,固体变为棕黑色。
(1)、用离子方程式表示溶液显碱性的原因:。(2)、将固体a过滤、洗涤,放置在空气中,固体变为棕黑色。①甲同学认为固体a中除了MnS外,还有 , 依据的现象是。
②乙同学认为根据上述现象不能得出固体a中含有 , 应补充对比实验:(填实验方案)。实验证实固体a中含有。
(3)、固体b的主要成分是S。分析产生S的可能原因:。(4)、经检验,固体c的主要成分是。①分析产生的可能原因:酸性条件下,将氧化。该反应的离子方程式是。
(5)、②继续滴加酸性溶液,溶液变为紫红色,仍有棕黑色固体。实验Ⅱ:改用未经酸化的溶液重复实验Ⅰ,产生棕黑色固体时溶液呈绿色。
分析实验Ⅰ未见绿色的原因:取少量实验Ⅱ的绿色溶液,滴加硫酸,溶液变为紫红色,产生棕黑色固体。该反应的离子方程式是。
(6)、实验Ⅲ:向未经酸化的溶液中滴加少量 , 产生棕黑色沉淀并检测到。检验的实验方案:(填操作和现象)。注:该实验条件下,与不反应。
(7)、综合上述实验,与溶液反应的产物与等因素有关(答出两点即可)。