广东省2023年普通高中学业水平选择考模拟测试(一)化学试题
试卷更新日期:2023-04-13 类型:高考模拟
一、单选题
-
1. 我国“人造太阳”创世界新纪录、“奋斗者”号载人潜水器成功坐底、“深海一号”母船助力深潜科考、北斗卫星导航系统全面开通,均展示了我国科技发展的巨大成就。下列相关叙述错误的是A、在“人造太阳”中发生核聚变的H、H是H的同位素 B、“奋斗者”号载人潜水器球壳所使用的钛合金能承受深海高压 C、“深海一号”母船海水浸泡区的铝基牺牲阳极可保障船体不易腐蚀 D、“北斗卫星”的授时系统“星载铷钟”中铷元素的单质遇水能缓慢反应放出H22. 在中国灿烂的农耕文明发展过程中,产生了许多有关农业生产与生活的化学智慧。对下列史料记载的判断错误的是A、将大豆煮熟后与面粉混合加醋曲酿醋:该过程不涉及氧化还原反应 B、用糯米石灰浆修筑长城:糯米石灰浆属于复合材料 C、用高粱制作饴糖(主要成分为麦芽糖);麦芽糖与蔗糖互为同分异构体 D、胡桐树的树脂可作金银焊药:胡桐树脂的主要成分属于天然高分子化合物3. 高铁酸钠(Na2FeO4)是一种新型净水剂,可用于饮用水处理。湿法制高铁酸钠的反应原理为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。下列有关说法错误的是A、H2O的球棍模型为
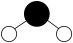 B、基态Fe3+的简化电子排布式为[Ar]3d34s2
C、NaClO的电子式为
B、基态Fe3+的简化电子排布式为[Ar]3d34s2
C、NaClO的电子式为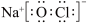 D、37Cl原子结构示意图为
D、37Cl原子结构示意图为 4. 如图所示为氮元素的价类二维图。下列有关说法错误的是
4. 如图所示为氮元素的价类二维图。下列有关说法错误的是 A、a的化学性质不活泼,常用作保护气 B、“雷雨发庄稼”涉及的转化过程包含a→c→d→e C、b与e按物质的量之比为1:1完全反应,所得生成物的水溶液呈中性 D、f既有氧化性,又有还原性5. 拟在实验室完成一系列实验:①粗盐提纯;②利用提纯后的NaCl模拟“侯氏制碱法”制备纯碱;③用盐酸标准液滴定纯碱溶液以测定Na2CO3含量。在实验过程中,下列仪器不可能用到的是A、
A、a的化学性质不活泼,常用作保护气 B、“雷雨发庄稼”涉及的转化过程包含a→c→d→e C、b与e按物质的量之比为1:1完全反应,所得生成物的水溶液呈中性 D、f既有氧化性,又有还原性5. 拟在实验室完成一系列实验:①粗盐提纯;②利用提纯后的NaCl模拟“侯氏制碱法”制备纯碱;③用盐酸标准液滴定纯碱溶液以测定Na2CO3含量。在实验过程中,下列仪器不可能用到的是A、 B、
B、 C、
C、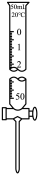 D、
D、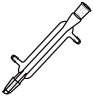 6. 下列陈述I和陈述II均正确且存在因果关系的是
6. 下列陈述I和陈述II均正确且存在因果关系的是选项
陈述I
陈述II
A
Al具有两性
常温下可用铝制容器盛装浓硝酸
B
Na2O2具有氧化性
Na2O2可氧化CO2产生氧气
C
纯碱溶液呈碱性
纯碱溶液可用于清洗厨房油污
D
SO2具有漂白性
SO2通入紫色石蕊溶液后溶液褪色
A、A B、B C、C D、D7. “劳动创造幸福,实干成就伟业。”下列劳动项目与所涉及的化学知识关联错误的是选项
劳动项目
化学知识
A
用硅单质制作太阳能电池板
硅元素在地壳中含量丰富
B
用高浓度白酒浸泡药材制成药酒
相似相溶原理
C
用KSCN溶液检验菠菜中是否含铁元素
含Fe3+的溶液遇SCN-变为红色
D
用ClO2给自来水消毒
ClO2具有强氧化性
A、A B、B C、C D、D8. 运载火箭常用偏二甲肼[(CH3)2N-NH2]与N2O4作推进剂,二者反应生成CO2、N2和H2O。设NA为阿伏加德罗常数的值,下列有关说法正确的是A、偏二甲肼中N原子的杂化类型均为sp2 B、1molH2O含有的中子数为10NA C、标准状况下,2.24LCO2中的σ键数目为0.4NA D、92gNO2和N2O4混合气体含有的原子数为6NA9. 一种锂的氧化物的晶胞结构如图所示(晶胞参数a=b=c=0.4665nm,晶胞棱边夹角均为90°)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。下列有关说法错误的是 A、该氧化物的化学式为Li2O B、O原子之间的最短距离为×466.5pm C、与Li距离最近且相等的O有8个 D、若p原子的分数坐标为( , , ),则q原子的分数坐标为( , , )10. 一种由短周期主族元素组成的化合物的结构如图所示。元素a、b、c、d、e的原子序数依次增大,a位于s区,e与其他四种元素不在同一个周期。下列说法正确的是
A、该氧化物的化学式为Li2O B、O原子之间的最短距离为×466.5pm C、与Li距离最近且相等的O有8个 D、若p原子的分数坐标为( , , ),则q原子的分数坐标为( , , )10. 一种由短周期主族元素组成的化合物的结构如图所示。元素a、b、c、d、e的原子序数依次增大,a位于s区,e与其他四种元素不在同一个周期。下列说法正确的是 A、第一电离能:b>c>d B、化合物ec3是非极性分子 C、简单氢化物的稳定性:b>d D、元素的电负性:e>d>c11. 下列反应的离子方程式书写正确的是A、等体积、等浓度的NaHSO4溶液与Ba(OH)2溶液混合:H+++Ba2++OH-=BaSO4↓+H2O B、将Fe2O3溶于过量HI溶液:Fe2O3+6H+=2Fe3++3H2O C、向AgCl悬浊液中滴加足量Na2S溶液:AgCl(s)+S2-(aq)Ag2S(s)+Cl-(aq) D、向酸性KMnO4溶液中滴加NaHSO3溶液:2+5+6H+=2Mn2++5+3H2O12. 25℃时,H2SeO4第一步完全电离,第二步电离平衡常数Ka=2.18×10-2。则25℃时,下列说法正确的是A、KHSeO4的溶液显碱性 B、K2SeO4溶液中存在c(K+)=2[c(HSeO)+c(SeO)] C、0.5mol/L的H2SeO4溶液中,c(HSeO)+2c(SeO)+c(OH-)=0.5mol/L D、向H2SeO4溶液中滴加KOH溶液至中性时,=2.18×10413. 根据以下实验操作及现象,能推出相应结论的是
A、第一电离能:b>c>d B、化合物ec3是非极性分子 C、简单氢化物的稳定性:b>d D、元素的电负性:e>d>c11. 下列反应的离子方程式书写正确的是A、等体积、等浓度的NaHSO4溶液与Ba(OH)2溶液混合:H+++Ba2++OH-=BaSO4↓+H2O B、将Fe2O3溶于过量HI溶液:Fe2O3+6H+=2Fe3++3H2O C、向AgCl悬浊液中滴加足量Na2S溶液:AgCl(s)+S2-(aq)Ag2S(s)+Cl-(aq) D、向酸性KMnO4溶液中滴加NaHSO3溶液:2+5+6H+=2Mn2++5+3H2O12. 25℃时,H2SeO4第一步完全电离,第二步电离平衡常数Ka=2.18×10-2。则25℃时,下列说法正确的是A、KHSeO4的溶液显碱性 B、K2SeO4溶液中存在c(K+)=2[c(HSeO)+c(SeO)] C、0.5mol/L的H2SeO4溶液中,c(HSeO)+2c(SeO)+c(OH-)=0.5mol/L D、向H2SeO4溶液中滴加KOH溶液至中性时,=2.18×10413. 根据以下实验操作及现象,能推出相应结论的是选项
实验操作
现象
结论
A
向丙烯醛(CH2=CHCHO)中加入橙色的溴水,振荡
溴水褪色
丙烯醛与Br2发生加成反应
B
向Na2S溶液中滴加浓盐酸
产生臭鸡蛋气味的气体
非金属性:Cl>S
C
向苯酚浊液中滴加少量Na2CO3溶液
浊液变澄清
酸性:苯酚>
D
向盛有等体积、等浓度的H2O2溶液的两支试管中分别加入0.2mL等浓度的CuSO4溶液和KMnO4溶液
加KMnO4溶液的试管中产生气泡的速率更快
比Cu2+的催化效果好
A、A B、B C、C D、D14. 一种含P催化剂催化甲烷中的碳氢键活化的反应机理如图所示。下列有关说法错误的是 A、催化循环中Pt的配位数有3种 B、a中Pt的化合价为+2价 C、c→d发生的是氧化还原反应 D、SO2与SO3的VSEPR模型名称不同15. 汽车尾气的排放会对环境造成污染。利用高效催化剂处理汽车尾气中的NO与CO的反应为2NO(g)+2CO(g)N2(g)+2CO2(g) △H<0。一定温度下,在恒容密闭容器中加入1molCO和1molNO发生上述反应,部分物质的体积分数(φ)随时间(t)的变化如图所示。下列说法正确的是
A、催化循环中Pt的配位数有3种 B、a中Pt的化合价为+2价 C、c→d发生的是氧化还原反应 D、SO2与SO3的VSEPR模型名称不同15. 汽车尾气的排放会对环境造成污染。利用高效催化剂处理汽车尾气中的NO与CO的反应为2NO(g)+2CO(g)N2(g)+2CO2(g) △H<0。一定温度下,在恒容密闭容器中加入1molCO和1molNO发生上述反应,部分物质的体积分数(φ)随时间(t)的变化如图所示。下列说法正确的是 A、上述反应的正反应在高温下才能自发进行 B、曲线b表示的是φ(N2)随时间的变化 C、2v正(NO)=v逆(N2)时,反应达平衡状态 D、气体的平均相对分子质量:M(t1)>M(t3)>M(t5)16. 我国科学家设计了一种新型的溴基液流可充电电池用于大规模储能,其放电时的工作原理如图所示。下列有关说法错误的是
A、上述反应的正反应在高温下才能自发进行 B、曲线b表示的是φ(N2)随时间的变化 C、2v正(NO)=v逆(N2)时,反应达平衡状态 D、气体的平均相对分子质量:M(t1)>M(t3)>M(t5)16. 我国科学家设计了一种新型的溴基液流可充电电池用于大规模储能,其放电时的工作原理如图所示。下列有关说法错误的是 A、放电时,M为正极 B、放电时,N极发生的电极反应为Br-+2Cl--2e-= C、充电时,每生成1molTiO2+ , 有2molH+穿过质子交换膜进入N极室 D、充电时,总反应为2Ti3+++2H2O=2TiO2++Br-+2Cl-+4H+
A、放电时,M为正极 B、放电时,N极发生的电极反应为Br-+2Cl--2e-= C、充电时,每生成1molTiO2+ , 有2molH+穿过质子交换膜进入N极室 D、充电时,总反应为2Ti3+++2H2O=2TiO2++Br-+2Cl-+4H+二、非选择题
-
17. 海洋中有丰富的NaCl资源。研究表明,氯离子的侵入是造成钢筋混凝土腐蚀的主要原因(Na+对腐蚀无影响)。海砂经淡化后,Cl-的含量达到一定标准才能作建筑用砂。某合作学习小组猜测Cl-会加快金属与盐溶液或酸溶液的反应速率。(1)、工业上通过电解饱和NaCl溶液制Cl2的离子方程式为。(2)、实验室用如图所示装置模拟工业上制Cl2。检验产生的Cl2的操作及现象是。
 (3)、探究Cl-是否会加快金属与盐溶液的反应速率。
(3)、探究Cl-是否会加快金属与盐溶液的反应速率。①小组同学利用图1所示装置进行探究。当Zn-Cu原电池工作约30s后,向电池槽内加入少量NaCl固体,电流随时间的变化如图2所示。甲同学认为加入NaCl固体后电流强度增大并不能说明Cl-会加快金属与盐溶液的反应速率,其理由可能是。

②乙同学利用温度传感器进行探究。分别取20mL0.1mol/LCuSO4溶液于A、B两个100mL烧杯中;向B烧杯中加入5gNaCl固体,使其溶解。在相同温度下,分别往两个烧杯中加入相同的用砂纸打磨过的镁条,采集温度数据,得出Cl-会加快金属与盐溶液的反应速率。已知0-100sA烧杯中溶液温度随时间的变化如图所示,请在答题卡相应位置画出0~100sB烧杯中溶液温度随时间的变化情况(100s时反应仍在进行) 。
 (4)、探究Cl-是否会加快金属与酸溶液的反应速率。小组同学的实验记录如表:
(4)、探究Cl-是否会加快金属与酸溶液的反应速率。小组同学的实验记录如表:实验序号
Zn片
酸
其他试剂
生成VmLH2的时间
I
完全相同
100mL0.1mol/L硫酸溶液
—
t1
II
100mL0.2mol/L盐酸
—
t2
III
100mLamol/L硫酸溶液
少量_
t3
其中,t1>t2 , t1>t3。
①由实验I和实验II(填“能”或“不能”)推知Cl-会加快金属与酸溶液的反应速率,理由是。
②小组同学一致认为,由实验I和实验III可推知Cl-会加快金属与酸溶液的反应速率,则实验III中,a处填 , b处填。
(5)、提出一种合理的降低海砂中Cl-含量的方法:。18. 利用转炉烟尘(主要成分:CuO、ZnO、PbO、Sb4O6、As2O5)制备硫酸铜联产硫酸锌以及聚合硫酸铁的工艺流程如图:
已知:
①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中×100%]越大,絮凝效果越好。
回答下列问题:
(1)、“酸浸渣”所含金属化合物是(填化学式)。常温下,调节“酸浸液”pH为(保留两位有效数字)时,溶液中c(Cu2+)=0.01mol/L。(2)、生成Ca3(AsO4)2·Ca(OH)2的化学方程式为。(3)、在一定温度下,将NaClO3加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。①x和y的关系应满足:y=(用含x的式子表示)。
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是。
 (4)、①“萃余液”经、、过滤、洗涤,得到ZnSO4·7H2O晶体。
(4)、①“萃余液”经、、过滤、洗涤,得到ZnSO4·7H2O晶体。②加热ZnSO4·7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4·7H2O(M=287g/mol)加热到145℃时得到ZnSO4·xH2O,其中x的值为;温度为1050℃时,ZnSO4固体完全分解为ZnO以及两种气体(只有一种是氧化物),该反应的化学方程式为。
 19. 甲烷的直接转化具有较高的经济价值,因此备受科学家关注。请回答下列问题:(1)、用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
19. 甲烷的直接转化具有较高的经济价值,因此备受科学家关注。请回答下列问题:(1)、用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:方法I:CH4(g)+O2(g)CH3OH(g) △H1=-126.4kJ•mol-1
方法II:CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2
已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ•mol-1 , 则△H2=。
(2)、某工厂采用方法Ⅰ生产甲醇。在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。
①下列措施可以提高CH4的平衡转化率的是(填标号)。
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为(精确到0.1%)。
③该反应温度下,方法I的标准压力平衡常数=(列出计算式)。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)gG(g)+hH(g), = , 其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是。
(3)、为提高生产效率,利用方法Ⅱ进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。
已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是;请从反应速率的角度说明,通入CH4后反应温度维持在200℃的原因:。
(4)、用ZrO2/NiCo2O4作电解催化剂也可以实现甲烷的直接转化,装置如图所示。
写出ZrO2/NiCo2O4电极的反应式:。
20. 化合物H是一种抗过敏药物,其合成路线如图:
已知:R1-CH=CH2+CH2=CH-R2R1-CH=CH-R2+CH2=CH2。回答下列问题:
(1)、C中含氧官能团的名称为。(2)、⑥的反应类型为。(3)、下列有关说法正确的是(填标号)。a.A的名称为丙烯 b.反应③的原子利用率为100%
c.F能发生氧化反应、取代反应和加成反应 d.G易溶于水
(4)、已知②为取代反应,则②的化学方程式为。(5)、写出E的结构简式,并用*标出其中的手性碳原子:。(6)、芳香族化合物M与H互为同分异构体,写出一种满足下列条件的H的结构简式:(任写一种)。i.苯环上有三个取代基;
ii.能与FeCl3溶液发生显色反应;
iii.核磁共振氢谱确定分子中有12个化学环境相同的氢原子。
(7)、参照上述合成路线,设计以 和
和 为原料合成
为原料合成 的路线(无机试剂任选):。
的路线(无机试剂任选):。