江苏省苏州市常熟市、张家港市、昆山市、太仓市2023年中考一模化学试题
试卷更新日期:2023-04-13 类型:中考模拟
一、选择题
-
1. 坚持生态优先、绿色发展理念,下列做法与之不相符的是( )A、直接焚烧垃圾 B、发展公共交通 C、合理使用农药 D、鼓励植树造林2. 下列物质中,不属于空气成分的是( )A、O2 B、H2 C、CO2 D、N23. 下列物质由离子构成的是( )A、铜 B、水 C、氯化钠 D、氖气4. 下列物质溶解或稀释时,有明显吸热的是( )A、硝酸铵 B、氯化钠 C、浓硫酸 D、氢氧化钠5. 合理施用肥料是粮食增产的保障。下列化肥中,属于磷肥的是( )A、K2SO4 B、Ca3(PO4)2 C、K2CO3 D、CO(NH2)26. 发酵粉主要成分之一是NaHCO3 , 它能使糕点多孔松软。主要是因为在焙制时生成了( )A、CO2 B、Na2O C、NaOH D、Na2CO37. 下列有关化学用语表示正确的是( )A、2个氢原子:H2 B、铝离子:Al+3 C、3个氮分子:3N2 D、硫酸铁:FeSO48. 下列实验操作正确的是( )A、塞紧胶塞
 B、加入固体
B、加入固体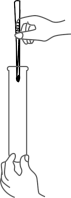 C、量取液体
C、量取液体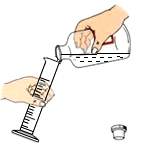 D、加入酒精
D、加入酒精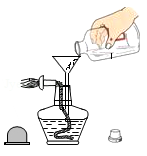 9. 丹霞地貌的岩层因含氧化铁而呈红色,在元素周期表中铁元素的某些信息如图所示,下列有关铁的说法错误的是( )
9. 丹霞地貌的岩层因含氧化铁而呈红色,在元素周期表中铁元素的某些信息如图所示,下列有关铁的说法错误的是( ) A、元素符号为Fe B、属于金属元素 C、中子数为20 D、铁元素的相对原子质量为55.8510. 阅读下列材料,完成下面小题:
A、元素符号为Fe B、属于金属元素 C、中子数为20 D、铁元素的相对原子质量为55.8510. 阅读下列材料,完成下面小题:2023年3月22日是第31届“世界水日”。“世界水日”的宗旨是唤起公众的节水意识,加强水资源保护。水影响着生产生活的方方面面:饮用、洗涤、灌溉、灭火等都需要水;工业上还通过电解水获取氧气。
自然界中的海水、河水、地下水等需要经过净化后才能被饮用;机场,车站等公共场所设有许多直饮水机能济白来水进一化处理得到在饮水,某处理水的过程如下图所示。
 (1)、适合张贴在学校水龙头旁的节水标志是( )A、
(1)、适合张贴在学校水龙头旁的节水标志是( )A、 B、
B、 C、
C、 D、
D、 (2)、下列“水”属于纯净物的是( )A、海水 B、河水 C、地下水 D、蒸馏水(3)、对自来水净化为直饮水过程的说法错误的是( )A、碳罐中颗粒活性炭的主要作用是吸附杂质 B、超滤膜是除去水中颗粒较小的不溶性杂质 C、紫外灯管照射的作用是对水进行杀菌消毒 D、自来水和直饮水所含水分子的组成不相同(4)、下列说法正确的是( )A、用含洗涤剂的水洗去油污是乳化作用 B、工业废水不需要处理就可以直接灌溉 C、用水灭火的原理是降低可燃物着火点 D、电解水获取H2 , 说明水中含有氢分子11. 树立安全意识,做到“加强防范,守护生命”。下列做法符合安全要求的是( )A、在面粉加工厂附近进行焊接 B、室内起火,迅速打开门窗通风 C、食用甲醛溶液浸泡过的食物 D、毒品危害人体健康,禁止吸毒12. 水壶中的水烧开沸腾后,壶盖被顶起。下列对宏观事实的微观解释正确的是( )A、水分子体积增大 B、水分子质量增大 C、水分子间空隙增大 D、水分子数目增多13. 下列有关金属或合金的说法正确的是( )A、金和铝都有得好的抗腐蚀性,是因为二者的化学性质都很稳定 B、常温下,所有的金属都是固体 C、合金中至少含有两种金属 D、金属的回收利用是保护金属资源的有效途径之一14. 氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法错误的是( )
(2)、下列“水”属于纯净物的是( )A、海水 B、河水 C、地下水 D、蒸馏水(3)、对自来水净化为直饮水过程的说法错误的是( )A、碳罐中颗粒活性炭的主要作用是吸附杂质 B、超滤膜是除去水中颗粒较小的不溶性杂质 C、紫外灯管照射的作用是对水进行杀菌消毒 D、自来水和直饮水所含水分子的组成不相同(4)、下列说法正确的是( )A、用含洗涤剂的水洗去油污是乳化作用 B、工业废水不需要处理就可以直接灌溉 C、用水灭火的原理是降低可燃物着火点 D、电解水获取H2 , 说明水中含有氢分子11. 树立安全意识,做到“加强防范,守护生命”。下列做法符合安全要求的是( )A、在面粉加工厂附近进行焊接 B、室内起火,迅速打开门窗通风 C、食用甲醛溶液浸泡过的食物 D、毒品危害人体健康,禁止吸毒12. 水壶中的水烧开沸腾后,壶盖被顶起。下列对宏观事实的微观解释正确的是( )A、水分子体积增大 B、水分子质量增大 C、水分子间空隙增大 D、水分子数目增多13. 下列有关金属或合金的说法正确的是( )A、金和铝都有得好的抗腐蚀性,是因为二者的化学性质都很稳定 B、常温下,所有的金属都是固体 C、合金中至少含有两种金属 D、金属的回收利用是保护金属资源的有效途径之一14. 氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法错误的是( ) A、盐酸中存在的微粒有水分子和氯化氢分子 B、该反应的微观实质是H+和OH-结合生成水分子 C、Na+和Cl-在该反应过程中没有被消耗 D、恰好完全反应时,溶液呈中性15. 下列劳动课程中的项目与所被及的化学知识相符的是( )
A、盐酸中存在的微粒有水分子和氯化氢分子 B、该反应的微观实质是H+和OH-结合生成水分子 C、Na+和Cl-在该反应过程中没有被消耗 D、恰好完全反应时,溶液呈中性15. 下列劳动课程中的项目与所被及的化学知识相符的是( )选项
劳动项目
化学知识
A
用食醋洗去锅上的水垢
醋具有挥发性
B
用煤气灶炒菜
燃气燃烧放热
C
清理家中鱼缸并通入氧气
氧气具有助燃性
D
用厨余垃圾腐烂自制肥料
物质发生剧烈的氧化反应
A、A B、B C、C D、D16. 根据如图溶解度曲线,得到的结论正确的是( ) A、MgSO4的溶解度大于NaCl的溶解度 B、在t1℃时,NaCl和MgSO4的溶解度相等 C、将t2℃时MgSO4的饱和溶液温度升高至t3℃时,有晶体析出 D、MgSO4饱和溶液中溶质的质量分数随温度的升高而增大17. 下列实验操作、实验现象和结论不相符的是( )
A、MgSO4的溶解度大于NaCl的溶解度 B、在t1℃时,NaCl和MgSO4的溶解度相等 C、将t2℃时MgSO4的饱和溶液温度升高至t3℃时,有晶体析出 D、MgSO4饱和溶液中溶质的质量分数随温度的升高而增大17. 下列实验操作、实验现象和结论不相符的是( )选项
A
B
C
D
实验操作




实验现象
下方蜡烛先熄灭
长颈漏斗内液柱上升,一段时间不下降
鸡蛋壳和醋酸反应产生气泡,澄清石灰水变浑浊
黄铜片和纯铜片互划,纯铜片上产生划痕
结论
二氧化碳不燃烧,不支持燃烧,且密度比空气大
装置气密性良好
鸡蛋壳中含有钙元素
黄铜片的硬度大于纯铜片
A、A B、B C、C D、D二、填空题
-
18. 元宵节是中国的传统节日之一,被选入国家级非物质文化遗产。元宵节主要有吃汤圆、赏花灯、猜灯谜、放烟花等一系列传统民族活动。(1)、汤圆:汤圆是用糯米粉裹糖馅、肉馅等捏而成的。
①糯米粉成分之一为淀粉,检验淀粉的常用试剂是(填名称)。
②肉馅为人体提供的最主要营养物质是。
(2)、花灯:折纸、裁剪、粘贴、点燃蜡烛等是传统做花灯步骤。传统做花灯步骤中一定涉及化学变化的步骤是。(3)、灯谜面:千锤万凿出深山,烈火焚烧若等闲:粉骨碎身浑不怕,要留清白在人间(谜底:石灰石CaCO3)。写出烈火焚烧时发生反应的化学方程式:。(4)、烟花:烟火中含镁粉、硫粉等,放烟火时看到嘴眼的白光,闻到刺激性气味。①镁粉燃烧产生耀眼的白光,写出反应的化学方程式:。
②刺激性气味气体主要是(填化学式)。
三、综合题
-
19. 实验室制备CO2 , 并进行相关实验探究。(1)、Ⅰ.CO2的制备和收集

装置A中发生反应的化学方程式为。
(2)、收集纯净干燥的CO2①装置B中饱和NaHCO3溶液的作用是。
②装置C中试剂X应选用(填字母)。
a.稀H2SO4 b.浓H2SO4 c.KOH溶液
③检验D中CO2已集满的操作是。
(3)、Ⅱ.CO2的性质探究根据图中Y形管中的现象,推测出。
 (4)、Ⅲ.A中废液成分分析和处理
(4)、Ⅲ.A中废液成分分析和处理已知:部分银盐的溶解性如下表(20℃)
酸根
溶解性
Ag+
Cl-
Ag+
溶
不
不
废液成分的确定
【推测废液所含溶质】
推测一:CaCl2 推测二:CaCl2和HCl
【验证推测】
甲组同学用CuO验证,乙组同学用AgNO3溶液验证,都得出废液中的溶质是CaCl2和HCl;
丙组同学提出:乙组同学的验证不合理。
请分析甲组用CuO可行、乙组用AgNO3溶液不合理的原因:。
(5)、废液的处理用Na2CO3溶液将废液中的CaCl2和HCl除去。【提出问题】如何估算Na2CO3溶液的用量?
【进行实验】取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH(装置如图3所示,pH变化如图4所示)。

【结果讨论】
①a→b阶段,观察到烧杯中的现象是。
②b点后曲线平缓阶段,溶液中含量基本不变的阴离子是。
③c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100mL废液,所需5.3%的Na2CO3溶液的体积120mL(填“大于”、“等于”或“小于”)。
20. H2O2是一种重要的化学品。(1)、Ⅰ.H2O2的制备
已知:氧元素在元素周期表中的信息如图:

Ⅰ中反应有非金属氧化物生成,则该氧化物中除氧外一定含有(填元素名称)元素。
(2)、Ⅱ中发生化合反应,则单质X的化学式为。(3)、BaO2中的阴离子为 , 1个离子含有的电子数为。(4)、Ⅲ中发生复分解反应,则反应的化学方程式是。(5)、减压能够降低蒸馏温度,从H2O2化学性质角度说明V中采用减压蒸馏的原因:。(6)、Ⅱ.H2O2的应用火箭动力助燃剂:在火箭推进器中装有液态的肼(N2H4)和过氧化氢。当它们混合时,即产生大量N2和水蒸气,并放出大量热。
①写出该反应的化学方程式:。
②该反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:。
(7)、医用双氧水:浓度等于或低于3%的过氧化氢水溶液。用已知浓度硫酸酸化的KMnO4水溶液测定过氧化氢水溶液的浓度,反应的化学方程式为2KMnO4+3H2SO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O,准确量取34.00mL某未知浓度的过氧化氢水溶液(溶液密度近似为1g/mL),加入足量稀硫酸,逐滴滴加溶质质量分数为9.48%的KMnO4溶液,当恰好完全反应时,消耗高锰酸钾溶液的体积为20.00mL(溶液密度近似为1g/mL),通过计算判断该过氧化氢水溶液是否可以用作医用双氧水:[写出计算过程,已知:Mr(KMnO4)=158]。21. 能源不可或缺。(1)、能源的转化和储存 祝融号火星车上安装的太阳能板能将太阳能转化为能,为科学仪器供电。火星车顶部安装了集热窗,里面装有正十一烷,其熔点为-26℃。白天,火星表面温度可升高至35℃,这种物质会(填“吸收”或“放出”)热量而熔化;夜间,火星表面温度下降到-60℃时,这种物质凝固为火星车提供热量。 (2)、氢能源的获得 甲烷和水蒸气催化重整是取高统H2的方法之一,反应器中初始反应的生成物为H2和CO2 , 甲烷和水蒸气在催化剂并加热的条件下发生反应的化学方程式是。(3)、反应器中还存在如下反应:
(2)、氢能源的获得 甲烷和水蒸气催化重整是取高统H2的方法之一,反应器中初始反应的生成物为H2和CO2 , 甲烷和水蒸气在催化剂并加热的条件下发生反应的化学方程式是。(3)、反应器中还存在如下反应:ⅰ.CH4+H2OCO+3H2 ⅱ.CO+H2OCO2+H2 ⅲ.CH4C(s)+2H2
已知:s表示该物质为固态;H2中混有CO不易被除去。
①上述三个反应中化合价均有变化的元素有(填元素符号)。
②反应ⅰ因对反应器设备和催化剂产生不利影响。
③通过调控反应条件,使ⅰ中生成的CO在ⅱ中全部转化,目的是。
(4)、用CaO可以除去反应器中的CO2 , CaO消耗率随时间变化关系如图2所示。从t1开始,单位时间内CaO消耗率(填“升高”、“降低”或“不变”)。 (5)、能源的利用甲醇将被推广为汽车能源,醉和氧气在气缸中发生反应的微观过程如图3所示,甲醇的化学式是。22. 阅读下列有关锂的分段材料,回答相关问题(1)、Ⅰ.锂(Li)的用途:锂与水反应生成氢氧化锂(LiOH)和氢气,这是海水锂电池的反应原理之一。
(5)、能源的利用甲醇将被推广为汽车能源,醉和氧气在气缸中发生反应的微观过程如图3所示,甲醇的化学式是。22. 阅读下列有关锂的分段材料,回答相关问题(1)、Ⅰ.锂(Li)的用途:锂与水反应生成氢氧化锂(LiOH)和氢气,这是海水锂电池的反应原理之一。写出该反应原理的化学方程式:。
(2)、Ⅱ.锂矿石成分分析锂辉石的化学组成为LiAlSi2O6 , 是主要含锂矿石之一、常有微量的Na+、K+、Ca2+、Fe2+、Mn2+等离子混入而使锂辉石具有不同的颜色。
LiAlSi2O6也可表示为Li2O·Al2O3·xSiO2 , 其中x=。
(3)、Li元素在LiAlSi2O6中的质量分数为(列式计算,结果保留为0.01%);锂辉石矿中Li的实际含量低于这个值,原因是。(4)、Ⅲ.碳酸锂(Li2CO3)的制取将锂辉石和石灰石按一定的质量比配料,混合磨细,在高温下煅烧:向煅烧后的混合物中加水,浸取,得氢氧化锂浸出液和难溶性固体:分离后的氢氧化锂浸出液经蒸发浓缩后,加入纯碱析出碳酸锂固体,分离、洗涤、干燥得碳酸锂成品。
碳酸锂的溶解度与温度的关系见下表
温度/℃
0
20
40
60
80
100
溶解度/g
1.54
1.33
1.17
1.01
0.85
0.72
浸取氢氧化锂时,加水量太少导致氢氧化锂的浸出率;加水量太多,对后续操作的不利影响是;
(5)、加入纯碱析出碳酸锂固体的化学方程式是;分离出Li2CO3的实验操作是(填操作名称)。(6)、为减少碳酸锂因溶解而损失,选择(填“冰水”或“热水”)洗涤。23. 同学们设计了如图1所示实验,进行影响铁锈蚀因素的探究。一周后,试管A中铁钉几乎没有生锈,试管B中铁钉稍有生锈,试管C中铁钉明显锈蚀,试管D中铁钉严重锈蚀。
 (1)、试管B中使用“煮沸并迅速冷却的蒸馏水”,目的是。(2)、试管C中铁钉明显锈蚀而试管A中铁钉几乎没有生锈,由此可得出的结论是。(3)、对于试管B中铁钉稍有生锈,同学们展开深入研究,将煮沸并迅速冷却的蒸馏水倒入烧杯中,迅速倒入植物油铺满水面。然后将溶解氧传感器插入水中,通风环境中持续三天采集得到数据图像如图2所示(室温下,自然状况的水中溶解氧约为8-9 mg/L)。
(1)、试管B中使用“煮沸并迅速冷却的蒸馏水”,目的是。(2)、试管C中铁钉明显锈蚀而试管A中铁钉几乎没有生锈,由此可得出的结论是。(3)、对于试管B中铁钉稍有生锈,同学们展开深入研究,将煮沸并迅速冷却的蒸馏水倒入烧杯中,迅速倒入植物油铺满水面。然后将溶解氧传感器插入水中,通风环境中持续三天采集得到数据图像如图2所示(室温下,自然状况的水中溶解氧约为8-9 mg/L)。据此回答:
①B试管中铁钉也稍有生锈的原因是。
②为达到图1设计A、B、C实验的目的,针对B试管可采取的改进措施是。
(4)、分析A,B,C,D中的实验现象,可知(写化学式)的存在会加速铁的锈蚀。(5)、小丽同学猜测:铁锈蚀的快慢还可能与氧气的浓度有关,为判断该猜测是否正确,请你设计实验验证小丽同学的猜想,简述实验方案(实验方案包括操作、现象和结论)。
-