初中科学浙教版 八年级下册第三章 第三节 化学方程式同步练习
试卷更新日期:2023-04-11 类型:同步测试
一、单选题
-
1. 某新型锂离子电池的工作原理为LiCoO2+6Y=Li1-xCoO2 +LixC6 , 其中物质Y为( )A、C B、CO C、CO2 D、Li2O2. 某矿石样本只含有如图所示的四种元素,该矿石中可能含有的物质是( )
 A、CaCO3 B、FeS C、Al2O3 D、SiO23. 小舟误将少量高锰酸钾当成二氧化锰加入氯酸钾中进行加热制取氧气部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是( )
A、CaCO3 B、FeS C、Al2O3 D、SiO23. 小舟误将少量高锰酸钾当成二氧化锰加入氯酸钾中进行加热制取氧气部分物质质量随时间变化如图所示。下列关于该过程的说法正确的是( ) A、b代表高锰酸钾 B、c代表氧气 C、时刻,氧气开始产生 D、时刻,生成氧气的质量达到最大值4. X、Y、Z、W四种物质在一定条件下充分反应后,测得反应前后各物质的质量如下表,下列说法中正确的是 ( )
A、b代表高锰酸钾 B、c代表氧气 C、时刻,氧气开始产生 D、时刻,生成氧气的质量达到最大值4. X、Y、Z、W四种物质在一定条件下充分反应后,测得反应前后各物质的质量如下表,下列说法中正确的是 ( )物质
X
Y
Z
W
反应前的质量/g
22
34
2
0
反应后的质量/g
40
待测
2
16
A、表格中待测值为0 B、参与反应的Y和X的质量比是9∶17 C、Z在反应中一定是催化剂 D、W在该反应中是反应物5. 下图是一定量的B2和AB在一定条件下混合以及混合结果的模型,则( ) A、反应得到的生成物有两种 B、反应前后元素化合价不变 C、参加反应的两种分子个数比为3∶2 D、该反应为化合反应6. 下列关于2CO+O22CO2的理解不正确的是( )A、表示一氧化碳与氧气在点燃条件下反应生成二氧化碳 B、参加反应的一氧化碳与氧气的质量比为 5∶4 C、反应前后碳原子、氧原子的个数均不变 D、参加反应的氧气与生成的二氧化碳的分子个数比为1∶27. 下列实验现象无法用化学方程式解释的是( )A、
A、反应得到的生成物有两种 B、反应前后元素化合价不变 C、参加反应的两种分子个数比为3∶2 D、该反应为化合反应6. 下列关于2CO+O22CO2的理解不正确的是( )A、表示一氧化碳与氧气在点燃条件下反应生成二氧化碳 B、参加反应的一氧化碳与氧气的质量比为 5∶4 C、反应前后碳原子、氧原子的个数均不变 D、参加反应的氧气与生成的二氧化碳的分子个数比为1∶27. 下列实验现象无法用化学方程式解释的是( )A、 B、
B、 C、
C、 D、
D、 8. 如图是某两种物质在催化剂的作用下微观反应示意图。下列说法正确的是( )
8. 如图是某两种物质在催化剂的作用下微观反应示意图。下列说法正确的是( )
 A、反应物都是氧化物 B、该化学反应类型为分解反应 C、反应前后氢元素的化合价保持不变人 D、反应前后分子的数目发生了变化9. 某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是( )
A、反应物都是氧化物 B、该化学反应类型为分解反应 C、反应前后氢元素的化合价保持不变人 D、反应前后分子的数目发生了变化9. 某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表。根据表中信息,判断下列说法正确的是( )物质
X
O2
CO2
H2O
反应前质量/g
16
70
1
0
反应后质量/g
0
待测
45
36
A、该反应为不属于氧化反应 B、Ⅹ中一定含有碳、氢两种元素 C、表中“待测”值为5 D、反应生成的CO2和H2O的质量比为45:3610. 小乐为了检验气体X(纯净物),进行了如图所示实验。观察到实验①中干冷烧杯内壁有水珠,实验②中澄清石灰水变浑浊。则对气体X分析正确的是( ) A、根据实验①的现象,说明气体X含氢、氧元素 B、根据实验②的现象,说明气体X含碳、氧元素 C、根据实验①②的现象,说明气体X为CH4 D、根据实验①②的现象,说明气体X一定含碳、氢元素11. 下列化学方程式书写正确的是( )A、P+O2 PO2 B、2P+5O2 P2O5 C、4P+5O2 P2O5
A、根据实验①的现象,说明气体X含氢、氧元素 B、根据实验②的现象,说明气体X含碳、氧元素 C、根据实验①②的现象,说明气体X为CH4 D、根据实验①②的现象,说明气体X一定含碳、氢元素11. 下列化学方程式书写正确的是( )A、P+O2 PO2 B、2P+5O2 P2O5 C、4P+5O2 P2O5D、4P+5O2 2P2O512. 下列对质量守恒定律的理解最确切的是( )A、10克冰受热熔化成10克水 B、参加反应的氢气和氧气的体积一定等于生成水的体积 C、反应物的质量等于生成物的质量 D、参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和13. 氢气和氧气的混合气体10 g,点燃后生成水,并剩余1 g氢气,则原混合气体中,氢气和氧气的质量分别为( )A、2 g氢气和8 g氧气 B、1 g氢气和9 g氧气 C、5g氢气和5g氧气 D、4 g氢气和6 g氧气14. 已知反应3A+2B= C+2D,已知参加反应的A与B的质量比为2 :3,反应共生成了60 gC和D。若B的相对分子质量为36,则物质A的相对分子质量是( )A、16 B、32 C、54 D、7215. 根据化学方程式:2H2O2 H2↑+O2↑,判断下列说法正确的是( )①水分子是由两个氢原子和一个氧原子构成的②水是由氢元素和氧元素组成的③反应前后氢元素的化合价没有发生变化④水是由氧气单质和氢气单质组成的⑤反应前后氧原子和氢原子的数目不变⑥反应前后氧原子的质子数不变⑦生成的氢气和氧气的微粒数目之比是2 : 1⑧反应前后物质的总质量不变
A、①④⑤⑦⑧ B、②④⑤⑥⑦ C、①③④⑥⑧ D、②⑤⑥⑦⑧16. 在探究某物质的组成时,某实验小组的同学将该物质放在氧气中充分燃烧后,测得生成物有二氧化碳和水,你认为该物质的组成中( )A、一定含有碳、氢、氧三种元素 B、一定含有碳、氢元素,可能含有氧元素 C、一定含有碳、氧元素,可能含有氢元素 D、无法确定17. 现某溶液中大量存在 M、 、Cl-、 、Fe3+五种微粒,其个数之比为 1∶3∶4∶2∶2,试推断M为( )A、Al3+ B、OH- C、 D、Mg2+18. 将25 g A物质和5 g B物质混合,加热后发生化学反应,经分析,反应后的混合物含10 g A和11 g C,同时还含有一种物质D。若A、B、C、D的相对分子质量分别为30、20、44、18,则它们之间发生的化学反应可能是( )A、A+B=C+D B、A+2B=2C+D C、2A+B=2C+D D、2A+B=C+2D19. 下列图像符合描述情况的是( ) A、①表示:用KMnO4制取氧气时,随着反应进行,MnO2质量发生的变化 B、②表示:a、b两试管中分别装有等质量的双氧水,并向a试管中放入催化剂后,随着反应的进行,氧气的生成情况 C、③表示:用KMnO4制取氧气时,随着反应的进行,试管中剩余的固体质量变化情况 D、④表示:用双氧水制取氧气时,生成的氧气质量的变化情况20. 一定条件下,在一密闭容器内发生某化学反应,并测得反应前后各物质的质量如图所示。下列说法正确的是( )
A、①表示:用KMnO4制取氧气时,随着反应进行,MnO2质量发生的变化 B、②表示:a、b两试管中分别装有等质量的双氧水,并向a试管中放入催化剂后,随着反应的进行,氧气的生成情况 C、③表示:用KMnO4制取氧气时,随着反应的进行,试管中剩余的固体质量变化情况 D、④表示:用双氧水制取氧气时,生成的氧气质量的变化情况20. 一定条件下,在一密闭容器内发生某化学反应,并测得反应前后各物质的质量如图所示。下列说法正确的是( )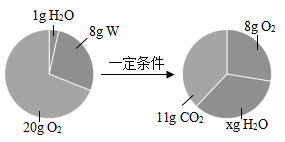 A、x的值为9 B、该反应中氧气与水的质量变化之比为6:5 C、W由碳、氢两种元素组成 D、W中碳、氢元素质量比为3:1
A、x的值为9 B、该反应中氧气与水的质量变化之比为6:5 C、W由碳、氢两种元素组成 D、W中碳、氢元素质量比为3:1二、填空题
-
21. 某硫铁矿厂开采的黄铁矿(主要成分是FeS2)是生产H2SO4的重要原料。利用黄铁矿生产H2SO4的第一步反应为4FeS2+11O2=2Fe2O3+8X。所得产物Fe2O3是冶炼铁的重要原料。回答下列问题。(1)、已知FeS2中Fe的化合价为+2,则S的化合价为。(2)、X的化学式是。22. 如何减少温室效应直是科学家重点关注的问题。科学家发现一种催化剂,可将二氧化碳转化为甲酸(CH2O2)。(1)、此反应前后,该催化剂的化学性质和保持不变。(2)、只用CO2一种反应物通过该催化剂 (选填“能”或“不能”)转化成甲酸(CH2O2),理由是。23. 价类二维图反映元素的化合价与物质类别之间的关系,如图是某同学绘制的关于碳元素的价类二维图。请回答:
 (1)、a点的物质类别为;(填“单质”或“化合物”)(2)、写出检验物质b的化学方程式。24. 1830年,法国科学家用白磷、硫磺(易燃物)、木条发明了“摩擦火柴”(如图甲),将火柴头在粗糙的界面上轻轻划动,便可引燃火柴杆,这种火柴会因为踩踏或老鼠啃食引发火灾。
(1)、a点的物质类别为;(填“单质”或“化合物”)(2)、写出检验物质b的化学方程式。24. 1830年,法国科学家用白磷、硫磺(易燃物)、木条发明了“摩擦火柴”(如图甲),将火柴头在粗糙的界面上轻轻划动,便可引燃火柴杆,这种火柴会因为踩踏或老鼠啃食引发火灾。1855年,瑞典科学家发明了“安全火柴”(如图乙) ,只需将火柴头快速从火柴盒侧面划过,便可引燃火柴,且保存和使用比“摩擦火柴”更加方便和安全。
资料一:白磷和红磷的部分性质如表。
资料二:玻璃粉是一种颗粒粗糙、化学性质稳定的粉末,能增大接触面粗糙程度。
资料三:氯酸钾受热易分解。

白磷 红磷 着火点 40℃ 260℃ 毒性 剧毒 无毒 结合上述材料和所学知识,解释:
(1)、使用“安全火柴”时,氯酸钾受热分解产生氧气的化学方程式。(2)、“安全火柴”比“摩擦火柴”保存和使用更安全的科学原理。(写出一条)25. 在宏观、微观和符号之间建立联系是科学学科的重要思维方式。
 (1)、图 1 为某原子结构模型的示意图,其中a、b、c 是构成该原子的三种不同粒子,其 中决定元素种类的粒子是 ; (选填图中字母)(2)、图 2 是某化学反应的微观示意图。反应的化学方程式为。该反应属于 反 应。 (填反应类型)26. 棉花在化学实验中经常被使用,如图所示的两组实验都用到棉花,其中图甲为用高锰酸钾制氧气实验,图乙为铁粉和水蒸气反应实验。
(1)、图 1 为某原子结构模型的示意图,其中a、b、c 是构成该原子的三种不同粒子,其 中决定元素种类的粒子是 ; (选填图中字母)(2)、图 2 是某化学反应的微观示意图。反应的化学方程式为。该反应属于 反 应。 (填反应类型)26. 棉花在化学实验中经常被使用,如图所示的两组实验都用到棉花,其中图甲为用高锰酸钾制氧气实验,图乙为铁粉和水蒸气反应实验。 (1)、图甲实验与图乙实验中,棉花的作用是不同的。请判断图甲实验中棉花的作用是;(2)、图甲实验和图乙实验中,气体产物也是不同的。实验进行之后,图乙实验试管中原有的铁粉变成了另一种黑色物质(经鉴定和铁在氧气中燃烧的产物一样),水槽处一个个气泡均附着在液面之上(水槽中加入肥皂水),肥皂泡内气体为自然界中最轻气体,试写出图乙实验中的化学反应方程式。27. 小明利用如图1装置,称量了白磷被引燃前后整个装置的总质量,验证了质量守恒定律。
(1)、图甲实验与图乙实验中,棉花的作用是不同的。请判断图甲实验中棉花的作用是;(2)、图甲实验和图乙实验中,气体产物也是不同的。实验进行之后,图乙实验试管中原有的铁粉变成了另一种黑色物质(经鉴定和铁在氧气中燃烧的产物一样),水槽处一个个气泡均附着在液面之上(水槽中加入肥皂水),肥皂泡内气体为自然界中最轻气体,试写出图乙实验中的化学反应方程式。27. 小明利用如图1装置,称量了白磷被引燃前后整个装置的总质量,验证了质量守恒定律。 (1)、该实验需不需要白磷过量?(填“需要”或“不需要”);实验过程中,可观察到气球体积变化情况是;(2)、图2中,锥形瓶种固态物质的质量m随时间t的变化关系正确的是。28. 将a g KClO3和b g MnO2混合加热,使之完全反应:(1)、若得到KCl为c g,则制得O2质量为g。(2)、若得到剩余固体质量为c g,则制得O2质量为g。(3)、若反应后固体质量减轻c g,则制得O2质量为g。
(1)、该实验需不需要白磷过量?(填“需要”或“不需要”);实验过程中,可观察到气球体积变化情况是;(2)、图2中,锥形瓶种固态物质的质量m随时间t的变化关系正确的是。28. 将a g KClO3和b g MnO2混合加热,使之完全反应:(1)、若得到KCl为c g,则制得O2质量为g。(2)、若得到剩余固体质量为c g,则制得O2质量为g。(3)、若反应后固体质量减轻c g,则制得O2质量为g。三、实验探究题
-
29. 小金进行如图所示实验来验证质量守恒定律。在实验中用电子天平和量筒准确测量出表中 、 、 、 和V。(实验中操作正确, 的密度为ρ )
实验序号
1
2
…
(试管)/g
(试管+加热后剩余固体)/g
量筒内收集气体的体积
 (1)、装置中试管口略向下倾斜的原因是。(2)、根据质量守恒定律, 、 、 、 和V和ρ之间应存在的等量关系为。(3)、每次实验结束后,小金在拆卸装置时总能闻到刺激性气味。他将加热后剩余固体中的 分离并测量其质量,发现总小于加热前 的质量。查阅资料后发现,一般认为加热 和 混合物的反应过程如下:第1步: ;(其中 有刺激性气味)
(1)、装置中试管口略向下倾斜的原因是。(2)、根据质量守恒定律, 、 、 、 和V和ρ之间应存在的等量关系为。(3)、每次实验结束后,小金在拆卸装置时总能闻到刺激性气味。他将加热后剩余固体中的 分离并测量其质量,发现总小于加热前 的质量。查阅资料后发现,一般认为加热 和 混合物的反应过程如下:第1步: ;(其中 有刺激性气味)第2步: ;
第3步: 。
写出加热后剩余固体中 质量小于加热前 质量的原因。
30. 某兴趣小组的同学设计了如图甲、乙、丙所示的三个实验(天平略)来验证质量守恒定律。 (1)、小组同学讨论后认为,上述甲、乙、丙三个实验装置中,只有实验能直接用于验证质量守恒定律;另外两个装置被否定的原因分别是。(2)、实验甲中锥形瓶底部放入细沙的作用是。(3)、图丁为图丙的改进实验。实验时将锥形瓶倾斜即可发生反应,其化学方程式为;该装置中小气球的作用是。31. 实验1中的红磷和实验2中的白磷都能与氧气反应生成五氧化二磷。
(1)、小组同学讨论后认为,上述甲、乙、丙三个实验装置中,只有实验能直接用于验证质量守恒定律;另外两个装置被否定的原因分别是。(2)、实验甲中锥形瓶底部放入细沙的作用是。(3)、图丁为图丙的改进实验。实验时将锥形瓶倾斜即可发生反应,其化学方程式为;该装置中小气球的作用是。31. 实验1中的红磷和实验2中的白磷都能与氧气反应生成五氧化二磷。
I.实验1中红磷需要稍过量的作用是 , 写出红磷燃烧的化学方程式。
Ⅱ.实验2中先把(含瓶塞、燃烧匙、药品及少量细砂)的集气瓶置于电子天平上称总质量,然后引燃白碳,反应停止并冷却后,再次称得总质量如图所示,该实验中的白磷(填“一定”或“不一定”)要过量。
32. 质量守恒定律的发现,凝聚了不少科学家的心血。材料一:1673年,英国化学家波义耳将某金属放在一个密闭容器中煅烧,煅烧后立即打开容器进行称量,结果发现煅烧后的固体质量增加了。
材料二:1774年,拉瓦锡用精确的定量实验研究在密封容器中氧化汞分解前的质量和分解后生成物的总质量之间的关系,证实了质量守恒定律。
请回答以下问题:
(1)、小明认为波义耳实验反应后虽然固体质量增加,也符合质量守恒定律,理由是。(2)、小明决定用如图装置模拟拉瓦锡实验,测定反应前氧化汞的质量和应后生成物的总质量是否相等来验证质量守恒定律。小明记录了以下几组数据:(已知:氧的密度为ρ克/毫升,氧化汞分解的化学方程式:2HgO=2Hg+O2↑)
①反应前称取的氧化汞质量a克
②反应前装有氧化汞试管的总质量b克
③反应结束冷却后试管的总质量c克
④反应前量筒的总质量e克
⑤反应后量筒内增加的水体积d毫升
⑥反应结束后量筒和水的总质量f克实验操作均正确,在误差范围内,如果出现等量关系(用上述字母表示),可用来验证质量守恒定律。
四、解答题
-
33. 常见的制氧剂有氯酸钠(NaClO3)、过氧化钙(CaO2) 和超氧化钾(KO2)等,这些制氧剂在一定条件下都可用来制取氧气,其反应原理分别为:2NaClO3 2NaCl+3O2↑,2CaO+2H2O=Ca(OH)2+O2↑,4KO2+2H2O=4KOH+3O2↑。(1)、以上三种制氧剂中属于氧化物的有(2)、3.6克过氧化钙(CaO2)中含氧元素的质量为克。(3)、若要制取相等质量的氧气,需要氯酸钠和超氧化钾的质量比为。34. 为测试学生的实验和计算能力,老师准备了一瓶没有贴标签的过氧化氢溶液,同学们取部分溶液进行了如下实验,请结合实验回答下列问题:
 (1)、产生氧气的质量为 g。(2)、计算该过氧化氢溶液中溶质的质量分数。35. 实验室制取氧气时,某同学取质量为x的高锰酸钾(KMnO4)加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题。
(1)、产生氧气的质量为 g。(2)、计算该过氧化氢溶液中溶质的质量分数。35. 实验室制取氧气时,某同学取质量为x的高锰酸钾(KMnO4)加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题。
 (1)、t0〜t1和t4〜t5时段固体质量都不变,为什么?(2)、已知两个高锰酸钾分子经过化学反应后能生成一个氧分子,请根据图中数据计算,高锰酸钾的质量x为多少?(3)、请在图乙所示的坐标图中,画出固体中锰元素质量在t0〜t5时段变化示意图。36. 为测定实验室中氯酸钾样品(杂质不参与反应)的纯度,取一定量该样品进行加热,记录不同时刻固体质量数据,如图甲。氯酸钾制取氧气的化学方程式为:2KClO3 2KCl+3O2↑
(1)、t0〜t1和t4〜t5时段固体质量都不变,为什么?(2)、已知两个高锰酸钾分子经过化学反应后能生成一个氧分子,请根据图中数据计算,高锰酸钾的质量x为多少?(3)、请在图乙所示的坐标图中,画出固体中锰元素质量在t0〜t5时段变化示意图。36. 为测定实验室中氯酸钾样品(杂质不参与反应)的纯度,取一定量该样品进行加热,记录不同时刻固体质量数据,如图甲。氯酸钾制取氧气的化学方程式为:2KClO3 2KCl+3O2↑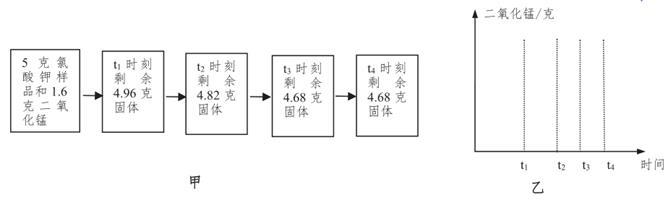 (1)、t1时刻产生的氧气质量是。(2)、t3~t4时段剩余固体质量不变的原因。(3)、计算该样品中氯酸钾的纯度。(4)、请在图乙中画出固体中二氧化锰质量在t1~t3时段的变化曲线。37. 钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。提示:食醋的主要成分是醋酸(HAc),醋酸和碳酸
(1)、t1时刻产生的氧气质量是。(2)、t3~t4时段剩余固体质量不变的原因。(3)、计算该样品中氯酸钾的纯度。(4)、请在图乙中画出固体中二氧化锰质量在t1~t3时段的变化曲线。37. 钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。提示:食醋的主要成分是醋酸(HAc),醋酸和碳酸钙反应的化学方程式为: 2HAc+CaCO3=CaAc2+H2O+CO2↑。该实验中浓硫酸的作用是吸收逸出的水蒸气, 鱼骨中其它成分与食醋反应生成的气体可忽略不计。
 (1)、该实验中仪器a的名称是。(2)、计算鱼骨中碳酸钙的质量分数。(3)、生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明。
(1)、该实验中仪器a的名称是。(2)、计算鱼骨中碳酸钙的质量分数。(3)、生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明。