辽宁省沈阳市和平区2022-2023学年九年级下学期化学学科学情调查问卷(零模统考)
试卷更新日期:2023-04-10 类型:中考模拟
一、单选题
-
1. 中华优秀传统文化底蕴深厚、源远流长,以下传统文化主要为化学变化的是( )A、山东剪纸 B、烧制陶瓷 C、果核雕刻 D、苏州刺绣2. 空气成分中,体积分数约为21%的是( )A、氮气 B、氧气 C、稀有气体 D、二氧化碳3. 下列物质分别放入水中,能形成溶液的是( )A、泥土 B、面粉 C、白糖 D、花生油4. 下列关于粗盐提纯的操作正确的是( )A、
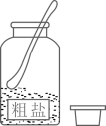 取样
B、
取样
B、 溶解
C、
溶解
C、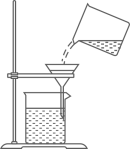 过滤
D、
过滤
D、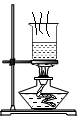 蒸发
5. 2021年5月22日,“祝融号”火星车安全驶离着陆平台,到达火星表面,开始巡视探测。锂离子蓄电池在“祝融号”供配电系统中起着十分重要的作用。在元素周期表中锂元素的某些信息如图所示,下列有关锂的说法错误的是( )
蒸发
5. 2021年5月22日,“祝融号”火星车安全驶离着陆平台,到达火星表面,开始巡视探测。锂离子蓄电池在“祝融号”供配电系统中起着十分重要的作用。在元素周期表中锂元素的某些信息如图所示,下列有关锂的说法错误的是( ) A、原子序数为3 B、元素符号为Li C、属于金属元素 D、相对原子质量为6.941g6. 下列做法错误的是( )A、高层楼房着火时,不能乘坐电梯逃离 B、在加油站张贴严禁烟火的标志 C、进入久未开启的地窖,要做灯火实验 D、家用电器着火时,立即用水扑灭7. 生活中下列物质的用途与其物理性质相关的是( )A、氧气用于医疗急救 B、活性炭用于吸附色素、异味 C、氮气用作食品包装袋中的填充气 D、氢气用作高能燃料8. 部分水果及饮料的pH如下表,下列说法正确的是( )
A、原子序数为3 B、元素符号为Li C、属于金属元素 D、相对原子质量为6.941g6. 下列做法错误的是( )A、高层楼房着火时,不能乘坐电梯逃离 B、在加油站张贴严禁烟火的标志 C、进入久未开启的地窖,要做灯火实验 D、家用电器着火时,立即用水扑灭7. 生活中下列物质的用途与其物理性质相关的是( )A、氧气用于医疗急救 B、活性炭用于吸附色素、异味 C、氮气用作食品包装袋中的填充气 D、氢气用作高能燃料8. 部分水果及饮料的pH如下表,下列说法正确的是( ) A、西瓜汁呈碱性 B、橘子汁中滴入石蕊试液,溶液变蓝 C、胃酸过多的人应该少饮柠檬水 D、苏打水呈酸性9. 用如图所示装置进行电解水实验(水中加入少量硫酸钠溶液以增强导电性),反应一段时间。下列说法正确的是( )
A、西瓜汁呈碱性 B、橘子汁中滴入石蕊试液,溶液变蓝 C、胃酸过多的人应该少饮柠檬水 D、苏打水呈酸性9. 用如图所示装置进行电解水实验(水中加入少量硫酸钠溶液以增强导电性),反应一段时间。下列说法正确的是( ) A、球形容器内液面下降 B、液体中硫酸钠的浓度不变 C、与电源负极相连的玻璃管内产生的气体质量约为正极的2倍 D、与电源正极相连的玻璃管内产生的气体能使带火星的木条复燃10. 布洛芬(C13H18O2)是家庭常备药品,可用于缓解轻至中度疼痛如头痛、牙痛等,也用于普通感冒或流行性感冒引起的发热。下列有关说法正确的是( )A、布洛芬中含有金属元素和非金属元素 B、1个布洛芬分子中含有33个原子 C、布洛芬中氢、氧元素的质量比为9:1 D、布洛芬的相对分子质量为206g11. 小华到水族馆参观时了解到:一些观赏鱼是从其他地方空运来的,而且必须密封,为了解决鱼的吸氧问题,可在水中加入一种叫做过氧化钙(化学式:CaO2)的制氧剂,它与水反应后的2种生成物可能是( )A、Ca(OH)2和O2 B、CaO和O2 C、CaSO4和O2 D、CaCl2和O212. 下列实验能达到相应目的是( )A、分离Zn和Cu的固体混合物:加适量的Cu(NO3)2溶液,过滤 B、除去CaCl2溶液中混入的少量盐酸:加过量Ca(OH)2固体,过滤 C、验证CO2中混有HCl气体:将气体通入硝酸银溶液,有白色沉淀产生 D、制备Cu(OH)2:将CuSO4溶液和适量Ba(OH)2溶液混合,过滤13. 归纳是学习化学常用的方法。下列知识归纳完全正确的是( )
A、球形容器内液面下降 B、液体中硫酸钠的浓度不变 C、与电源负极相连的玻璃管内产生的气体质量约为正极的2倍 D、与电源正极相连的玻璃管内产生的气体能使带火星的木条复燃10. 布洛芬(C13H18O2)是家庭常备药品,可用于缓解轻至中度疼痛如头痛、牙痛等,也用于普通感冒或流行性感冒引起的发热。下列有关说法正确的是( )A、布洛芬中含有金属元素和非金属元素 B、1个布洛芬分子中含有33个原子 C、布洛芬中氢、氧元素的质量比为9:1 D、布洛芬的相对分子质量为206g11. 小华到水族馆参观时了解到:一些观赏鱼是从其他地方空运来的,而且必须密封,为了解决鱼的吸氧问题,可在水中加入一种叫做过氧化钙(化学式:CaO2)的制氧剂,它与水反应后的2种生成物可能是( )A、Ca(OH)2和O2 B、CaO和O2 C、CaSO4和O2 D、CaCl2和O212. 下列实验能达到相应目的是( )A、分离Zn和Cu的固体混合物:加适量的Cu(NO3)2溶液,过滤 B、除去CaCl2溶液中混入的少量盐酸:加过量Ca(OH)2固体,过滤 C、验证CO2中混有HCl气体:将气体通入硝酸银溶液,有白色沉淀产生 D、制备Cu(OH)2:将CuSO4溶液和适量Ba(OH)2溶液混合,过滤13. 归纳是学习化学常用的方法。下列知识归纳完全正确的是( )A.性质与用途
B.数字的含义
①氧气能支持燃烧——可作燃料
②盐酸能与氧化铁反应——可用于除铁锈
H2O:“2”表示每个水分子中有两个氢原子
2H:“2”表示两个氢原子
C.能量观
D.燃烧现象
①手机锂电池充电是化学能转化为电能
②剧烈的氧化反应放热,缓慢氧化吸热
①硫在空气中燃烧产生明亮的蓝紫色火焰,放热
②铁丝在空气中剧烈燃烧、火星四射,生成黑色固体
A、A B、B C、C D、D二、综合题
-
14. 请利用所学化学知识回答下列问题:(1)、识别标签:如图为某天然矿泉水的标签。
水质主要成分(mg/L)
K+:0.62~ 3.25
Na+:18.75 ~ 29.8
Ca2+:17.8 ~ 26.2
Cl-:14.2 ~ 30.8
硫酸根:41.6~70.2
碳酸氢根:184~261
①请写出该标签中硫酸根的离子符号。
②可以用来检验该矿泉水是硬水还是软水。
③若该瓶矿泉水为2L,根据标签中的信息,则至少含有钾离子mg。
④写出由钙离子与氯离子构成的物质的化学式。
(2)、健康生活:防疫情,测体温。体温测量仪功不可没。①传统型——体温计。因为汞是人体中的(选填“必需”或“有害”)元素,含汞体温计将在2026年起全面禁止生产。汞的元素符号是。
②方便型——额温枪。某种额温枪的红外温度传感器所用材料含有钽酸锂(LiTaO3)。钽酸锂中锂元素(Li)的化合价为+1价,则钽元素(Ta)的化合价为价。
(3)、节能减排:节能减排中“减排”的一个重要手段是合理利用二氧化碳。科学家在一定条件下将二氧化碳转化为甲烷,其反应的微观过程如下图所示。
①甲、乙、丙、丁四种物质中属于氧化物的是(填化学式)。
②该反应的化学方程式是。
③通过分析该反应的微观过程。对于化学变化,从微观角度可以获得的信息是。(写出一条即可)
(4)、资源利用:盐田法是海水制盐的方法之一,其流程如图1所示。
①图1中M是池(填“蒸发”或“冷却”),结合图2的溶解度曲线,说明用盐田法从海水中制取氯化钠的理由是。
②由图2可知硝酸钾在t2℃时的溶解度为。
15. 根据下图所示的实验回答相关问题。
 (1)、实验一,通过对比铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明可燃物燃烧的条件之一是。(2)、实验二中能证明铁生锈与氧气有关的现象是。(3)、实验三,写出硬质玻璃管中发生反应的化学方程式 , 能说明硬质玻璃管中已开始发生反应的现象是 , 右边导管口放置点燃的酒精灯的目的是。16. 实验室现有如下气体制备装置,据图回答下列问题:
(1)、实验一,通过对比铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明可燃物燃烧的条件之一是。(2)、实验二中能证明铁生锈与氧气有关的现象是。(3)、实验三,写出硬质玻璃管中发生反应的化学方程式 , 能说明硬质玻璃管中已开始发生反应的现象是 , 右边导管口放置点燃的酒精灯的目的是。16. 实验室现有如下气体制备装置,据图回答下列问题: (1)、写出图中仪器名称:① , ②。(2)、用A装置制取氧气的化学方程式是 , 可以选用D装置收集氧气,依据是且不与空气中成分反应。(3)、用锌粒和稀盐酸制取H2 , 反应方程式为 , 其基本反应类型为 , 若要除去氢气中混有的氯化氢气体,可选用F装置,F中加入的药品是。17. 探究化学反应中物质质量的变化规律,装置如图。
(1)、写出图中仪器名称:① , ②。(2)、用A装置制取氧气的化学方程式是 , 可以选用D装置收集氧气,依据是且不与空气中成分反应。(3)、用锌粒和稀盐酸制取H2 , 反应方程式为 , 其基本反应类型为 , 若要除去氢气中混有的氯化氢气体,可选用F装置,F中加入的药品是。17. 探究化学反应中物质质量的变化规律,装置如图。 (1)、写出实验一中观察到的实验现象 , 从而证明“参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和”。(2)、实验二中点燃蜡烛后,天平指针向右偏转。蜡烛减小的质量(填“大于”“等于”或“小于”)燃烧后生成物的总质量。18. 为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴设计了一套实验装置(如下图),他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(质量和溶质质量分数均相同)进行反应,在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:
(1)、写出实验一中观察到的实验现象 , 从而证明“参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和”。(2)、实验二中点燃蜡烛后,天平指针向右偏转。蜡烛减小的质量(填“大于”“等于”或“小于”)燃烧后生成物的总质量。18. 为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴设计了一套实验装置(如下图),他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(质量和溶质质量分数均相同)进行反应,在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:
反应时间(秒)
20
40
60
80
100
120
140
收集到的气体体积(毫升)
甲金属
25
55
95
130
160
170
170
乙金属
30
75
125
150
150
150
150
(1)、由实验结果可知:金属活动性较强的是。(2)、根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道的一个信息是。(3)、为了使得到的实验数据准确,小吴在加入稀硫酸之前就将导管伸入装满水的量筒中(如图所示),你认为该做法合理吗?说出你的观点并阐述理由。(4)、反应停止并恢复至室温后,为准确读取生成气体的体积,读数前应采取的一个必要操作是。19. 碳酸钙遍布于自然界,大理石、石灰石、珊瑚、贝壳、蛋壳等很多物质的主要成分都是碳酸钙,化学兴趣小组的同学对碳酸钙进行了如下研究。(1)、活动一:认识实验室中的碳酸钙同学们用下图实验进行石灰石性质的探究。

用两支坩埚钳分别夹持大小相同的石灰石固体a、b,向图2中酒精灯的火焰通氧气,受热相同时间后冷却,将灼烧后的固体a、b分别放入盛有酚酞溶液的烧杯中,前者溶液不变色,后者溶液变为红色。根据上述实验回答问题:
上述实验现象说明固体a灼烧时没有发生化学发应,其本质原因是。
(2)、向酒精灯火焰通氧气(如图2)的目的是 , 灼烧时固体b发生反应的化学方程式为。(3)、酚酞试液变红,说明溶液呈性,用化学方程式表示其原因。据此可知,将生石灰加入水中也可获得石灰水。现将等质量的氧化钙和氢氧化钙固体,分别加入盛有等质量水的甲、乙两只烧杯中,搅拌后恢复至室温均全部溶解。对甲、乙烧杯中溶液的分析正确的是(填字母序号)。A.溶液的状态:乙一定是不饱和溶液
B.溶质的质量:甲大于乙
C.溶剂的质量:甲大于乙
D.溶质质量分数:甲乙可能相等
(4)、活动二:认识工业生产中的碳酸钙硫酸钾和氯化铵是农业上常用的化肥。下图是某工厂利用碳酸钙将废硫酸回收利用,并制备硫酸钾和氯化铵的工业流程,请你回答以下问题。

反应①之前,将CaCO3研磨成粉末的目的是。
(5)、操作I、操作II的名称是 , 其中玻璃棒的作用是。(6)、此流程中可循环利用的物质。(7)、硫酸钾在农业上用作 , 区分硫酸钾和氯化铵的方法:。(8)、活动三:认识生活中的碳酸钙鸡蛋壳的主要成分是碳酸钙,兴趣小组的同学为此开展了以下探究活动。
【提出问题】鸡蛋壳中CaCO3的质量分数是多少?
【查阅资料】碳酸钙是鸡蛋壳的主要成分,大约占蛋壳质量的83%~90%。
【实验装置】用如图装置进行实验(鸡蛋壳中其他成分不和盐酸反应)。

【实验步骤】
①在气密性良好的装置中装入药品。
②称量反应前烧杯和烧杯中液体的质量为140.0g。
③打开止水夹,迅速加入过量的稀盐酸。
④待反应停止后,立即称量烧杯和烧杯中液体的质量为144.4g。
【解释与结论】
实验中,判断反应停止的依据是 , 请根据实验数据计算:该鸡蛋壳样品中碳酸钙的质量分数为(计算结果精确到0.1%)。
(9)、实验测得的样品中碳酸钙的质量分数比实际值偏小,原因可能是____(填序号)。A、盐酸量不足,碳酸钙没有完全反应 B、CO2流速过快,排出的CO2没有完全被NaOH溶液吸收 C、反应容器中CO2有残留 D、NaOH溶液吸收了空气中的CO2 E、稀盐酸挥发出少量HCl气体