天津市河西区2023届高三下学期总复习质量调查(一)化学试题
试卷更新日期:2023-04-03 类型:高考模拟
一、单选题
-
1. 我国取得让世界瞩目的科技成果,化学功不可没。下列说法错误的是A、“北斗”系统芯片中的半导体材料为单晶硅 B、“奋斗者”号潜水器外壳的钛合金的硬度比纯钛的高 C、“嫦娥”五号运载火箭的液氧液氢推进剂的产物无污染 D、我国首创的“硅—石墨烯—锗晶体管”中所含元素均为短周期元素2. 下列过程体现所用物质的氧化性的是A、用溶液腐蚀铜板 B、用的水溶液吸收 C、用锌块防止钢铁船体腐蚀 D、用铁粉防止溶液变质3. 我国科学家在碳循环(如下图所示)研究方面取得成就。下列说法正确的是
 A、乙酸属于二糖 B、葡萄糖属于烃类 C、淀粉在一定条件下能水解成葡萄糖 D、22.4 L 被还原可生成1 mol CO4. 下列关于第三周期元素及相关物质的性质比较中,正确的是A、酸性: B、熔点:红磷>单晶硅 C、第一电离能:S>P D、热稳定性:5. 下列各组离子在指定溶液中能大量共存的是A、无色溶液中:、、 B、酸性溶液中:、、 C、碱性溶液中:、、 D、溶液中:、、6. 为减少环境污染,可利用活性炭发生脱硝反应: , 下列说法正确的是A、该反应可以自发进行 B、的电子式为
A、乙酸属于二糖 B、葡萄糖属于烃类 C、淀粉在一定条件下能水解成葡萄糖 D、22.4 L 被还原可生成1 mol CO4. 下列关于第三周期元素及相关物质的性质比较中,正确的是A、酸性: B、熔点:红磷>单晶硅 C、第一电离能:S>P D、热稳定性:5. 下列各组离子在指定溶液中能大量共存的是A、无色溶液中:、、 B、酸性溶液中:、、 C、碱性溶液中:、、 D、溶液中:、、6. 为减少环境污染,可利用活性炭发生脱硝反应: , 下列说法正确的是A、该反应可以自发进行 B、的电子式为 C、NO分子中含有非极性共价键
D、由CO难溶于水可推知其为非极性分子
7. 下列实验能达到实验目的的是
C、NO分子中含有非极性共价键
D、由CO难溶于水可推知其为非极性分子
7. 下列实验能达到实验目的的是A.制取乙烯
B.探究浓度对反应速率的影响
C.检验乙炔具有还原性
D.制取



 A、A B、B C、C D、D8. 下列方程式不能合理解释实验现象或事实的是A、湿润的淀粉KI试纸遇变蓝: B、电解溶液制取镁单质: C、钢铁发生吸氧腐蚀,正极反应: D、用除去输水管道中的:9. 新型的生物可降解高分子材料聚乳酸的合成如下:
A、A B、B C、C D、D8. 下列方程式不能合理解释实验现象或事实的是A、湿润的淀粉KI试纸遇变蓝: B、电解溶液制取镁单质: C、钢铁发生吸氧腐蚀,正极反应: D、用除去输水管道中的:9. 新型的生物可降解高分子材料聚乳酸的合成如下:
下列说法正确的是
A、 B、该反应属于消去反应 C、乳酸分子中含有键 D、乳酸分子中所有原子共平面10. 设为阿伏加德罗常数的值,下列叙述正确的是A、1 mol 中配位键的数目为12 B、标准状况下,22.4 L 中含非极性键的数目为 C、常温下1 L的溶液中,由水电离出的数目为 D、2 mol NO和1 mol 在密闭容器中充分反应后可得分子总数目为211. 目前发展势头强劲的绿色环保储能电池——钒电池的工作原理如下图所示,放电时电子由B极沿导线向A极移动,电解质溶液含硫酸,下列说法正确的是 A、基态原子钒的价层电子排布式为 B、放电时H+由B极经离子交换膜向A极移动 C、充电时电池被氧化为 D、充电时A极反应为12. 室温下,向20.0 mL 0.100 mol∙L−1的某弱酸HA的溶液中滴加同浓度的NaOH溶液,过程中随pH的变化关系如下图所示。下列说法错误的是
A、基态原子钒的价层电子排布式为 B、放电时H+由B极经离子交换膜向A极移动 C、充电时电池被氧化为 D、充电时A极反应为12. 室温下,向20.0 mL 0.100 mol∙L−1的某弱酸HA的溶液中滴加同浓度的NaOH溶液,过程中随pH的变化关系如下图所示。下列说法错误的是 A、a到c的过程中,为定值 B、a到c的过程中,水的电离程度不断减小 C、b点时, D、c点时加入碱的体积小于20 mL
A、a到c的过程中,为定值 B、a到c的过程中,水的电离程度不断减小 C、b点时, D、c点时加入碱的体积小于20 mL二、非选择题
-
13. 治疗疟疾的有效药物青蒿素是白色针状晶体,受热不稳定,易溶于乙醇和乙醚。按要求回答下列问题。(1)、青蒿素的提取:在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚()提取,效果更好。
①乙醇的沸点高于乙醚,原因是。
②用乙醚提取效果更好,原因是。
(2)、青蒿素的结构①分子中C、H、O的原子半径最大的是 , 电负性最大的是。
②测定晶体结构最常用的方法是、 , 经计算等过程得出其晶胞(长方体,棱长分别为a nm、b nm、c m,含4个青蒿素分子)及分子结构如下图甲所示。

③测定其分子的相对分子质量为282,其物理方法是。
④晶体的密度为(阿伏加德罗常数的值设为;列出表达式)。
(3)、青蒿素结构的修饰:一定条件下,用将青蒿素选择性反应,结构修饰为双氢青蒿素(如上图乙)。①青蒿素结构修饰发生的反应类型为 , 其过程中杂化轨道发生变化的碳原子的杂化方式变为。
②的空间结构名称为。
③从结构与性质关系的角度推测双氢青蒿素比青蒿素的水溶性、疗效更好的原因:。
14. 抗击新型冠状病毒的潜在用药之一肉桂硫胺的一种合成路线如下(部分条件已略):
按要求回答下列问题。
(1)、C的分子式为;A的结构简式为 , F中官能团的名称为。(2)、B→C反应类型为;为检验C中所含官能团种类,所需试剂有。(3)、写出的反应化学方程式:。(4)、与苯丙酸(F的加氢产物)互为同分异构体的含酯基的一取代芳香族化合物有种;写出其中支链上核磁共振氢谱有3组吸收峰、且峰面积之比为的同分异构体的结构简式:。(5)、参考以上合成路线信息,以1-丙醇和必要的试剂为原料,合成正丁酸。将合成路线写在下列方框中。……
15. 某小组同学设计如下实验装置制备高铁酸钾(夹持装置略),同时探究制备的适宜条件,已知:常温下,为紫色固体,微溶于KOH溶液。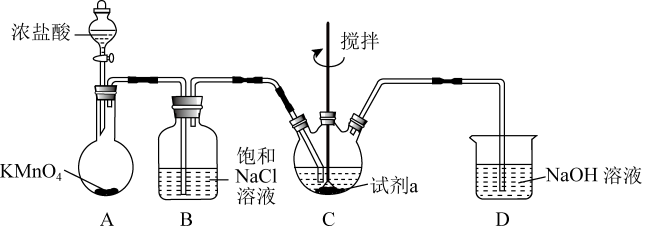 (1)、装置A反应中的氧化剂为。(2)、进一步设计如下对比实验,探究在不同试剂a对产率的影响。已知实验中,溶液总体积、和的物质的量、的通入量均相同。
(1)、装置A反应中的氧化剂为。(2)、进一步设计如下对比实验,探究在不同试剂a对产率的影响。已知实验中,溶液总体积、和的物质的量、的通入量均相同。实验编号
试剂a
实验现象
i
溶液和少量KOH
无明显现象
ii
溶液和过量KOH
得到紫色溶液,无紫色固体
iii
溶液和过量KOH
得到深紫色溶液,有紫色固体
①对比实验i与ii现象,提出假设;“实验ii溶液碱性较强,、增强+3价铁的还原性”验证此假设的实验装置如图所示:

当通入 , 电压表示数为;再向右侧烧杯中加入的试剂为 , 电压表示数为;且观察(填“>”“<”或“=”)证明上述假设成立。
②配平实验iii中反应的离子方程式:
□□□□□□
③实验ii中的产率比实验iii的低,其原因可能是。
(3)、随着反应的发生,装置B中不断有白色片状固体产生。①结合化学用语解释该现象:;
②若拆除装置B,而使的产率降低的原因是。
(4)、向实验ii所得紫色溶液中继续通入 , 溶液紫色变浅,的产率降低。可能原因是通入的消耗了KOH,写出该反应的离子方程式:。(5)、综上可知制备 , 所需的适宜条件是。16. 在某空间站氧循环系统中,涉及电解水,还有碳中和反应(如下):。按要求回答下列问题。(1)、电解液态水制备1 mol 的反应中,。写出燃烧热的热化学方程式:。(2)、系统碳中和反应的平衡常数(K)与反应温度(t)之间的关系如图1所示。
①由图1可推知:该反应的0(填“>”或“<”);
②若系统碳中和反应为基元反应,且反应的与活化能(Ea)的关系为。在图2中补充完成该反应过程的能量变化示意图。

③某小组模拟该反应,t℃下,向容积为10 L的密闭容器中通入5.2 mol 和0.9 mol , 反应平衡后测得容器中。则的转化率为 , 平衡常数的值为。
(3)、在相同条件下与还会发生不利于氧循环的如下副反应:。在反应器中按通入反应物,在不同温度、不同催化剂条件下,反应进行到2 min时,测得反应器中、浓度()如下表所示。催化剂
A
10.8
12722
345.2
41780
B
9.2
10775
34
39932
①在选择使用催化剂A和350℃条件下反应,0~2 min生成的平均反应速率为;
②若某空间站的生命保障系统实际选择使用催化剂B和400℃的反应条件,其理由是。