四川省凉山彝族自治州2023届高三下学期第二次诊断检测理科综合化学试题
试卷更新日期:2023-04-03 类型:高考模拟
一、单选题
-
1. 化学和生活、社会发展息息相关。下列说法正确的是A、将铬、锰加入普通钢中制成不锈钢,使钢铁制品永不生锈 B、核酸检测时用到的“拭子”由尼龙纤维制成,属于有吸附性的天然有机高分子材料 C、化石燃料脱硫与碳达峰、碳中和无关 D、广汉三星堆出土的青铜器深埋于地下而生锈,是因为发生了析氢腐蚀2. 水杨酸(
 )是制备阿司匹林(
)是制备阿司匹林( )的原料,水杨酸的结构修饰经历了数百年,由阿司匹林再到长效缓释阿司匹林,大幅提升了治疗效果。一种制备水杨酸的流程如图所示,下列说法正确的是
)的原料,水杨酸的结构修饰经历了数百年,由阿司匹林再到长效缓释阿司匹林,大幅提升了治疗效果。一种制备水杨酸的流程如图所示,下列说法正确的是 A、甲苯中所有原子共面 B、步骤②反应为加成反应 C、1mol阿司匹林与足量氢氧化钠溶液反应时,最多可消耗1molNaOH D、可以通过分子结构的修饰获得疗效更佳、作用时间更长的缓释阿司匹林3. 下列操作和实验目的均正确的是
A、甲苯中所有原子共面 B、步骤②反应为加成反应 C、1mol阿司匹林与足量氢氧化钠溶液反应时,最多可消耗1molNaOH D、可以通过分子结构的修饰获得疗效更佳、作用时间更长的缓释阿司匹林3. 下列操作和实验目的均正确的是 A、用甲装置收集NO气体 B、乙装置中II有平衡气压的作用,可将多余气体直接排出到空气中 C、用丙装置制取并收集干燥纯净的NH3 D、用丁装置(环己醇与浓硫酸混合加热脱水)制备环己烯,反应过程中,分水器中有水积攒就应该立即打开活塞放出。4. 短周期主族元素W、X、Y、Z的原子序数依次增大。W与X不在同周期, X原子的最外层电子数与核外电子总数之比为3:4,Y、Z相邻,Y的单质在空气中燃烧,产物有两种离子化合物和一种单质。下列说法错误的是A、简单离子的半径:X> Y>Z B、工业上常用电解熔融YX制备Y单质 C、Z2(SO4)3溶液是泡沫灭火器原料之一,原理利用了Z离子的水解 D、X的某氢化物可作为杀菌消毒剂5. 用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如图所示,已知钯(Pd)常以正二价形式存在。下列有关说法正确的是
A、用甲装置收集NO气体 B、乙装置中II有平衡气压的作用,可将多余气体直接排出到空气中 C、用丙装置制取并收集干燥纯净的NH3 D、用丁装置(环己醇与浓硫酸混合加热脱水)制备环己烯,反应过程中,分水器中有水积攒就应该立即打开活塞放出。4. 短周期主族元素W、X、Y、Z的原子序数依次增大。W与X不在同周期, X原子的最外层电子数与核外电子总数之比为3:4,Y、Z相邻,Y的单质在空气中燃烧,产物有两种离子化合物和一种单质。下列说法错误的是A、简单离子的半径:X> Y>Z B、工业上常用电解熔融YX制备Y单质 C、Z2(SO4)3溶液是泡沫灭火器原料之一,原理利用了Z离子的水解 D、X的某氢化物可作为杀菌消毒剂5. 用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如图所示,已知钯(Pd)常以正二价形式存在。下列有关说法正确的是 A、H2O2的电子式为
A、H2O2的电子式为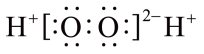 B、反应①②③均为氧化还原反应
C、反应②中有1molO2参与反应时转移电子的物质的量为2mol
D、反应过程中[PbCl2O2]2−、HCl均为该反应的催化剂
6. 科学家设计了一种将苯酚(C6H5OH)氧化为CO2和H2O的原电池-电解池组合装置如图所示,已知羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。下列说法错误的是
B、反应①②③均为氧化还原反应
C、反应②中有1molO2参与反应时转移电子的物质的量为2mol
D、反应过程中[PbCl2O2]2−、HCl均为该反应的催化剂
6. 科学家设计了一种将苯酚(C6H5OH)氧化为CO2和H2O的原电池-电解池组合装置如图所示,已知羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。下列说法错误的是 A、高温下不利于该电池的使用 B、电池工作一段时间后, NaCl溶液浓度将降低 C、d电极的电极反应为:H2O-e-=·OH+H+ D、相同时间内,c、d两极产生气体的体积比(相同条件下)为3:77. 已知MgF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节MgF2浊液的pH,测得在不同pH条件下,体系中−lgc(X)(X为Mg2+或F-)与lg的关系如图所示。下列说法正确的是
A、高温下不利于该电池的使用 B、电池工作一段时间后, NaCl溶液浓度将降低 C、d电极的电极反应为:H2O-e-=·OH+H+ D、相同时间内,c、d两极产生气体的体积比(相同条件下)为3:77. 已知MgF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节MgF2浊液的pH,测得在不同pH条件下,体系中−lgc(X)(X为Mg2+或F-)与lg的关系如图所示。下列说法正确的是 A、Ksp(MgF2)的数量级为10−9 B、L1代表−lgc(Mg2+)与lg的变化曲线 C、a、c两点的溶液中均存在2c(Mg2+)<c(F-)+c(HF) D、c点的溶液中存在c(Cl-)>c(Mg2+)>c(HF)>c(H+)
A、Ksp(MgF2)的数量级为10−9 B、L1代表−lgc(Mg2+)与lg的变化曲线 C、a、c两点的溶液中均存在2c(Mg2+)<c(F-)+c(HF) D、c点的溶液中存在c(Cl-)>c(Mg2+)>c(HF)>c(H+)二、非选择题
-
8. 硫酸铜主要用作纺织品媒染剂、农业杀虫剂等,其晶体(CuSO4·xH2O)在不同温度下会逐步失去结晶水甚至分解。某小组对硫酸铜晶体性质进行探究,回答下列问题:(1)、[探究一]验证硫酸铜晶体的分解产物
某小组同学对某温度下硫酸铜晶体的分解产物进行验证,设计了如下实验:

观察到的实验现象有:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中无水硫酸铜变蓝;C中产生白色沉淀;D中品红溶液褪色;E中溶液变为红色。
装有无水硫酸铜的仪器名称为 , C、D两装置位置 (填“ 能”或“不能”)交换。
(2)、C中产生的沉淀的化学式为 , E中Fe2+发生反应的离子方程式为。(3)、该实验设计的不足之处是。(4)、[探究二]测定硫酸铜晶体中结晶水含量实验步骤:①称取mg硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴酸A酸化。
②向①所得溶液中滴加足量BaCl2溶液,得到白色沉淀,将所得沉淀过滤、洗涤。
③将洗涤后的沉淀充分干燥后称得其质量为ag。
步骤①酸A应该选择 ( 填“稀盐酸”或者“稀硫酸”),滴加酸A的目的是。
(5)、步骤②检验沉淀是否洗涤干净的方法是。(6)、根据实验数据,硫酸铜晶体( CuSO4·xH2O)中x= (用含 m、a的代数式表示)。9. 某工厂利用黄铁矿(FeS2)和电解金属锰后的阳极渣(主要成分MnO2 , 杂质为Pb、Fe、Cu元素的化合物)为原料制备高性能磁性材料MnCO3的I工艺流程如下:
回答下列问题:
(1)、FeS2中硫元素化合价为 , 滤渣I的成分除了S还有。(2)、写出任意两种加快酸浸速率的措施、。“除铁、铜”过程中加入H2O2的目的是。(3)、请结合平衡移动原理解释“除钙”时溶液酸度不宜过高,否则溶液中Ca2+沉淀不完全的原因是:。(4)、“沉锰”时发生反应的离子方程式为:。“沉锰”时需缓慢向含MnSO4的溶液中滴加NH4HCO3 , 否则会发生反应MnCO3(s) + 2OH-(aq)Mn(OH)2(s) +(aq)而生成Mn(OH)2 , 该反应的平衡常数K=(保留一位小数,已知: Ksp[Mn(OH)2]=1.9 ×10-13 , Ksp(MnCO3)=2.2× 10-11)。(5)、用惰性电极电解酸性MnSO4溶液还可制备MnO2 , 其阳极反应式为。10. NOx会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:(1)、选择性催化还原技术(SCR)是针对柴油车尾气排放中的一项处理工艺。已知在催化剂的作用下,有如下反应发生:①4NH3(g) + 5O2(g) 4NO (g) + 6H2O(g) ΔH1= - 905kJ·mol-1
②4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) ΔH2=- 1268kJ· mol-1
③4NH3(g) + 6NO(g) 5N2(g) + 6H2O(g) ΔH3
反应③的反应热ΔH3=。
(2)、氨催化氧化时会发生(1)中的①、②两个竞争反应。为研究某催化剂的效果,在1L恒容密闭容器中充入1molNH3和2molO2 , 测得反应达到平衡时有关物质的量关系如图:
①根据以上信息,其他条件不变时,下列措施中可以提高NH3转化为N2的平衡转化率的是(填字母)。
A.升高反应温度 B.降低反应温度
C.增大NH3和O2的初始投料比 D.及时分离出H2O
②520℃-840℃时体系中NO含量迅速增加的原因是。
(3)、已知:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化如图a。
I.2NO(g) N2O2(g)
II.N2O2(g)+O2(g) 2NO(g)
①决定NO氧化反应速率的步骤是(填“I”或“II”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,在温度为T1和T2(T2>T1),测得c(NO)随t(时间)的变化曲线如图b,转化相同量的NO,在温度 (填“T1”或“T2”)下消耗的时间较长,结合图a分析其原因。
 (4)、在恒温条件下,向初始压强为pMPa的恒容密闭容器中加入等物质的量CO和NO发生反应: 2CO(g)+2NO(g)N2(g)+2CO2(g),反应达平衡时,N2的体积分数为20%,则NO的转化率为(保留一位小数)。该条件下反应平衡常数Kp= MPa-1(用平衡分压代替平衡浓度计算,分压=总压 ×物质的量分数)。11. 铜、银、金在古代常用作货币,三种元素在周期表中位于同一族,回答下列问题:(1)、基态铜原子有种能量不同的电子,其价层电子排布式为:。(2)、熔点Cu Ag( 填“大于”或“小于”),原因是。(3)、Cu2+能与吡咯(
(4)、在恒温条件下,向初始压强为pMPa的恒容密闭容器中加入等物质的量CO和NO发生反应: 2CO(g)+2NO(g)N2(g)+2CO2(g),反应达平衡时,N2的体积分数为20%,则NO的转化率为(保留一位小数)。该条件下反应平衡常数Kp= MPa-1(用平衡分压代替平衡浓度计算,分压=总压 ×物质的量分数)。11. 铜、银、金在古代常用作货币,三种元素在周期表中位于同一族,回答下列问题:(1)、基态铜原子有种能量不同的电子,其价层电子排布式为:。(2)、熔点Cu Ag( 填“大于”或“小于”),原因是。(3)、Cu2+能与吡咯( )的阴离子(
)的阴离子( )形成双吡咯铜。
)形成双吡咯铜。①1mol吡咯中含有的σ键数为 , 吡咯熔点远高于环戊二烯(
 ), 主要原因是。
), 主要原因是。②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N的杂化方式为。吡咯中的大π键可表示为。(大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数, 如苯分子中的大π键可表示为 )。
(4)、Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进到入Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构如下图所示,该晶体储氢后的化学式为。
若合金晶胞边长为apm,忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为。(写出表达式即可,储氢能力=)
12. 布洛芬具有抗炎、解热、镇痛作用,其一种合成路线如下图所示。回答下列问题: (1)、布洛芬中所含官能团的名称为:。(2)、A的系统命名为: , 1molC最多可以和molH2发生加成反应。(3)、D的同分异构体中,苯环上的一氯代物只有一种的有 种,写出其中任意一种的结构简式。(4)、B→C的化学方程式为: , 反应类型为。(5)、布洛芬显酸性,对肠、胃道有刺激作用,用
(1)、布洛芬中所含官能团的名称为:。(2)、A的系统命名为: , 1molC最多可以和molH2发生加成反应。(3)、D的同分异构体中,苯环上的一氯代物只有一种的有 种,写出其中任意一种的结构简式。(4)、B→C的化学方程式为: , 反应类型为。(5)、布洛芬显酸性,对肠、胃道有刺激作用,用 对其进行成酯修饰能改善这种情况。成酯修饰时发生反应的化学方程式为:。 (6)、已知:NaBH4单独使用能还原醛、酮,不能还原羧酸。根据布洛芬合成路线中的相关知识,以甲苯、CH3COCl为主要原料(其它无机试剂任用),用不超过三步的反应设计合成
对其进行成酯修饰能改善这种情况。成酯修饰时发生反应的化学方程式为:。 (6)、已知:NaBH4单独使用能还原醛、酮,不能还原羧酸。根据布洛芬合成路线中的相关知识,以甲苯、CH3COCl为主要原料(其它无机试剂任用),用不超过三步的反应设计合成 , 合成路线为。
, 合成路线为。