四川省巴中市2023届高三一诊考试理综化学试题
试卷更新日期:2023-04-03 类型:高考模拟
一、单选题
-
1. 近年来我国在航天、航空领域取得巨大成就。下列有关说法错误的是A、C919机身采用了第三代铝锂合金,具有密度低、强度高等优良特点 B、C919的平垂尾使用的T800级高强度碳纤维,属于无机非金属材料 C、问天实验舱太阳翼配置的是三结砷化镓电池,砷化镓喻为“半导体贵族” D、神舟飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐2. NA是阿伏加德罗常数的值,下列说法错误的是A、1mol甲苯中碳碳双键的数目为0.3NA B、标准状况下,2.24LSO3中原子数目大于0.4NA C、1L0.1mol·L-1Na2S溶液中S2-数目小于0.1NA D、2.0g重水(D2O)中质子数目为NA3. 有机物M是合成青蒿素的原料之一,M的结构简式如图所示。下列有关M的说法正确的是
 A、分子式为C12H16O5 B、能发生氧化反应,但不能发生取代反应 C、不可用钠鉴别M中的两种含氧官能团 D、烃基上的一氯代物只有一种4. W、X、Y、Z为原子序数依次增大,且为不同主族的短周期元素,四种元素的最外层电子数满足W+X=Y+Z,WZ4是一种常见的有机溶剂。下列叙述正确的是A、原子半径:Z>Y>X>W B、W与X形成的共价化合物中,W和X均满足8电子稳定结构 C、Y的氧化物一定为碱性氧化物 D、用惰性电极电解熔融的Y与Z形成的化合物一定能得到对应的单质5. 下列实验方案能达到实验目的的是
A、分子式为C12H16O5 B、能发生氧化反应,但不能发生取代反应 C、不可用钠鉴别M中的两种含氧官能团 D、烃基上的一氯代物只有一种4. W、X、Y、Z为原子序数依次增大,且为不同主族的短周期元素,四种元素的最外层电子数满足W+X=Y+Z,WZ4是一种常见的有机溶剂。下列叙述正确的是A、原子半径:Z>Y>X>W B、W与X形成的共价化合物中,W和X均满足8电子稳定结构 C、Y的氧化物一定为碱性氧化物 D、用惰性电极电解熔融的Y与Z形成的化合物一定能得到对应的单质5. 下列实验方案能达到实验目的的是选项
A
B
C
D
目的
配制100mL
0.1mol·L-1的硫酸
除去氯气中的HCl气体
由FeCl3溶液制取FeCl3固体
判断2NO2(g)N2O4(g)的热效应
实验
方案



 A、A B、B C、C D、D6. 25℃时,-1gc(X)与pH的关系如图所示,X代表Zn2+或Fe2+或 , 下列说法正确的是
A、A B、B C、C D、D6. 25℃时,-1gc(X)与pH的关系如图所示,X代表Zn2+或Fe2+或 , 下列说法正确的是
已知:常温下,Fe(OH)2的Ksp=-8.1×10-16;强碱性溶液中Zn元素主要以的形式存在。
A、曲线②代表-lgc(Zn2+)与pH的关系 B、常温下,Zn(OH)2的Ksp的数量级为10-18 C、向等浓度的ZnCl2和FeCl2的混合溶液中滴入NaOH溶液,Zn2+先沉淀 D、向c[]=0.1mol·L-1的溶液中加入等体积0.1mol·L-1的HCl后,体系中Zn元素只以Zn(OH)2的形式存在7. 锂离子电池应用广泛,某课题组使用纳米Si-C复合颗粒直接与锂接触,形成LixSi,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与O2/C电极匹配组成如图所示原电池。该电池的总反应为xO2+2LixSixLi2O2+2Si,下列说法错误的是 A、该电池放电时,a为负极 B、放电时,当负极质量减少14g时,电解液中转移1molLi+ C、充电和放电过程,电解液中Li+浓度都不会改变 D、电池充电时,阳极的电极反应为Li2O2-2e-=O2↑+2Li+
A、该电池放电时,a为负极 B、放电时,当负极质量减少14g时,电解液中转移1molLi+ C、充电和放电过程,电解液中Li+浓度都不会改变 D、电池充电时,阳极的电极反应为Li2O2-2e-=O2↑+2Li+二、非选择题
-
8. 硫代硫酸钠(Na2S2O3)在工业、医药等领域应用广泛。下图为实验室制取硫代硫酸钠的装置,反应过程中需通过pH传感器控制pH为7-8。
 (1)、盛Na2SO3的仪器名称为。(2)、为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是。(3)、若n(Na2CO3):n(Na2S)=1:2,则装置C中的化学反应方程式为:。(4)、当数据采集处pH接近7时,应采取的操作为。(5)、装置B中的药品可以选择下列物质中的____(填字母)。A、饱和NaHCO3溶液 B、饱和NaHSO3溶液 C、NaOH溶液 D、酸性KMnO4溶液(6)、现使用“碘量法”测定脱碳液中V2O5的含量:取mg脱碳液于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.1000mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,该过程的反应为I2+2Na2S2O3=2NaI+Na2S4O6。(已知有色离子仅有VO2+ , 其颜色为蓝色)
(1)、盛Na2SO3的仪器名称为。(2)、为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是。(3)、若n(Na2CO3):n(Na2S)=1:2,则装置C中的化学反应方程式为:。(4)、当数据采集处pH接近7时,应采取的操作为。(5)、装置B中的药品可以选择下列物质中的____(填字母)。A、饱和NaHCO3溶液 B、饱和NaHSO3溶液 C、NaOH溶液 D、酸性KMnO4溶液(6)、现使用“碘量法”测定脱碳液中V2O5的含量:取mg脱碳液于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.1000mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,该过程的反应为I2+2Na2S2O3=2NaI+Na2S4O6。(已知有色离子仅有VO2+ , 其颜色为蓝色)①滴定终点的现象为:。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量(填“偏大”、“偏小”、“无影响”)。
③脱碳液中V2O5的质量分数为%。
9. 某废铁铬催化剂(含Fe3O4、Cr2O3、MgO、Al2O3及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
已知:i.0.1mol·L-1金属离子形成氢氧化物沉淀与氢氧化物沉淀溶解的pH范围如下:
金属离子
Fe3+
Al3+
Cr3+
Fe2+
Mg2+
开始沉淀的pH
1.5
4.0
4.6
7.6
9.5
沉淀完全的pH
2.8
5.2
6.8
9.7
11.1
金属氢氧化物
Al(OH)3
Cr(OH)3
开始溶解的pH
7.8
12
溶解完全的pH
10.8
>14
ii.Cr(OH)3+OH-=+2H2O
iii.已知Cr的金属性强于Fe
(1)、加入铁粉后,调节pH的范围为。(2)、由滤渣1得到滤液3发生反应的离子方程式为。(3)、滤渣3成分的化学式为;回收铬时,铬的存在形式为(填化学式)。(4)、由滤液2得到结晶水合物的操作是、过滤、洗涤、干燥。(5)、滤渣2与FeS2混合后隔绝空气焙烧,总反应的化学方程式为;该过程加入少量CaO的目的是。(6)、酸浸过程中,在硫酸用量一定的情况下,随着酸浓度的增加,铁、铬的溶解度增大。实际生产中,硫酸的质量分数为50%,其原因是。(已知,Fe2(SO4)3▪ 9H2O,Cr2(SO4)3·18H2O在20℃时的溶解度分别为400g和64g)10. 我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]制备三甲胺[N(CH3)3]:(CH3)2NCHO(g)+2H2(g)N(CH3)3(g)+H2O(g),ΔH=-144kJ·mol-1。(1)、在上述反应中,每生成2g气态水,放出kJ的热量。(2)、在铜催化剂表面发生上述反应的历程如图所示(催化剂表面吸附物种用“*表示)。
①下列分步反应中,能垒最大的是(填标号)。
a.A→Bb.C→Dc.F→G
②A→B中,断裂共价键吸收的总能量催化剂吸附放出的总能量(填“大于”、“小于”或“等于”)。
③D→E的化学方程式为。
(3)、向体积相等的I、Ⅱ两个恒容密闭容器中分别充入1molDMF(g)和2molH2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
①容器I中为(填“绝热”或“恒温”)过程。判断的依据是。
②若该反应是在恒温恒容的密闭容器中发生,以下能说明该反应达到化学平衡状态的是。
A.混合气体的密度不再发生改变
B.反应容器中H2的质量分数不变
C.2v正(H2)=v逆(H2O)
D.平均相对分子质量不变
E.该反应的焓变,即ΔH不变
③n点时反应的平衡常数Kp=中的(Kpa-1)。(提示:用分压计算的平衡常数为Kp , 分压=总压×物质的量分数)
11. 我国科学家制备的NiO/Al2O3/Pt催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:H3NBH3+4CH3OHNH4B(OCH3)4+3H2↑。请回答下列问题:(1)、基态氮原子的价电子排布式为。(2)、硼烷又称硼氢化合物,随着硼原子数的增加,硼烷由气态经液态至固态,其原因为。(3)、某有机硼化合物的结构简式如图所示,其中氨原子的杂化轨道类型为。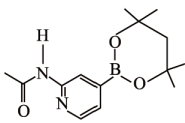 (4)、图a、b、c分别表示B、C、N、O的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填标号),判断的根据是;第二电离能的变化图是(填标号)。
(4)、图a、b、c分别表示B、C、N、O的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是(填标号),判断的根据是;第二电离能的变化图是(填标号)。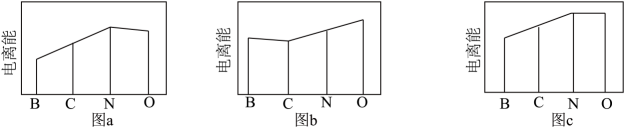 (5)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,
(5)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,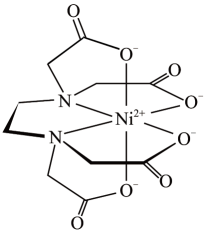
1个该配合物中通过螯合作用形成的配位键有个,在形成配位键前后C-N-C键角将(填“增大"“减少”或“不变”)。
(6)、BN晶体的晶胞如图所示,B、N的原子半径分别为apm和bpm,密度为2.25g·cm-3 , 阿伏加德罗常数的值为NA , BN晶胞中原子的体积占晶胞体积的百分率为。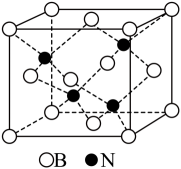 12. 某治疗新冠药物的中间体E合成路线如下,试回答下列问题:
12. 某治疗新冠药物的中间体E合成路线如下,试回答下列问题:
已知:
 , Me代表甲基,Et代表乙基。(1)、A的分子式为。(2)、B中最多有个原子共面,化合物CH3COCH2COOEt中官能团名称为 , 。(3)、反应④的反应类型是 , 反应③的化学方程式为。(4)、A水解产物的名称为 , 芳香化合物M的相对分子质量比A的水解产物多14,且M与A的水解产物互为同系物,则M的同分异构体有种。其中满足核磁共振氢谱峰面积之比为2:2:2:1:1的结构简式为。(5)、也可以用
, Me代表甲基,Et代表乙基。(1)、A的分子式为。(2)、B中最多有个原子共面,化合物CH3COCH2COOEt中官能团名称为 , 。(3)、反应④的反应类型是 , 反应③的化学方程式为。(4)、A水解产物的名称为 , 芳香化合物M的相对分子质量比A的水解产物多14,且M与A的水解产物互为同系物,则M的同分异构体有种。其中满足核磁共振氢谱峰面积之比为2:2:2:1:1的结构简式为。(5)、也可以用 制备G:请以
制备G:请以 为起始原料完成
为起始原料完成 合成的路线,注明条件,无机试剂自选。
合成的路线,注明条件,无机试剂自选。