上海市宝山区2022-2023学年高三一模化学试题
试卷更新日期:2023-04-03 类型:高考模拟
一、选择题
-
1. 漂粉精是生活中常见的消毒剂,其有效成分属于A、酸 B、碱 C、盐 D、氧化物2. 下列物质属于纯净物的是A、五水硫酸铜晶体 B、乙烯的聚合产物 C、石油的分馏产物 D、煤的气化产物3. 下列化工生产原理不涉及氧化还原反应的是A、溴的提取 B、氯碱工业 C、合成氨工业 D、海水晒盐4. 核聚变发电有望成为解决人类能源问题的重要手段之一,氘()是核聚变反应的主要原料,下列有关叙述错误的是A、的核电荷数为1 B、是自然界中最轻的原子 C、的核外电子数为1 D、和互称为同位素5. 科学素养包括规范使用化学用语。下列化学用语表达正确的是A、氟化氢的电子式:
 B、甲烷分子的球棍模型:
B、甲烷分子的球棍模型: C、硫离子的最外层电子排布式:
D、丙烯的结构简式:
6. 食醋是烹饪美食的调味品,其有效成分主要是醋酸(),下列说法正确的是A、属于离子晶体 B、含有非极性共价键 C、属于强电解质 D、含有酸基7. 实验室制备下列物质不需要用到酒精灯的是A、乙烯 B、乙炔 C、乙酸乙酯 D、乙酸丁酯8. 下列关于烷烃的命名正确的是A、2,3,4-三甲基丁烷 B、2-甲基-3-乙基戊烷 C、4-甲基戊烷 D、2-乙基丁烷9. 丙烯醛()是化工中很重要的合成中间体,广泛用于树脂生产和有机合成,下列试剂能用于检验丙烯醛中的“
C、硫离子的最外层电子排布式:
D、丙烯的结构简式:
6. 食醋是烹饪美食的调味品,其有效成分主要是醋酸(),下列说法正确的是A、属于离子晶体 B、含有非极性共价键 C、属于强电解质 D、含有酸基7. 实验室制备下列物质不需要用到酒精灯的是A、乙烯 B、乙炔 C、乙酸乙酯 D、乙酸丁酯8. 下列关于烷烃的命名正确的是A、2,3,4-三甲基丁烷 B、2-甲基-3-乙基戊烷 C、4-甲基戊烷 D、2-乙基丁烷9. 丙烯醛()是化工中很重要的合成中间体,广泛用于树脂生产和有机合成,下列试剂能用于检验丙烯醛中的“ ”的是 A、 B、 C、 D、10. 下列有关实验操作的叙述错误的是A、滴定管用水洗净后,加入待装液 B、配制溶液时,容量瓶不需干燥 C、测结晶水含量时,加热后的坩埚必须放在干燥器中冷却 D、过滤操作中,漏斗的尖端应接触烧杯内壁11. 下列关于硫及其化合物的说法正确的是A、硫单质易溶于水 B、通入溶液中生成沉淀 C、可作钡餐 D、浓硫酸可保存在铁罐中12. 下列关于铝及其化合物反应的离子方程式书写正确的是A、铝与NaOH溶液反应: B、与NaOH溶液反应: C、明矾净水原理: D、与过量氨水反应:13. 实验室模仿氯碱工业用如下图所示装置(X、Y是碳棒)进行由解饱和食盐水的实验。通电之后,发现X、Y电极上均有气泡产生,其中Y电极上的气泡相对X电极更密,关于该实验的叙述正确的是
”的是 A、 B、 C、 D、10. 下列有关实验操作的叙述错误的是A、滴定管用水洗净后,加入待装液 B、配制溶液时,容量瓶不需干燥 C、测结晶水含量时,加热后的坩埚必须放在干燥器中冷却 D、过滤操作中,漏斗的尖端应接触烧杯内壁11. 下列关于硫及其化合物的说法正确的是A、硫单质易溶于水 B、通入溶液中生成沉淀 C、可作钡餐 D、浓硫酸可保存在铁罐中12. 下列关于铝及其化合物反应的离子方程式书写正确的是A、铝与NaOH溶液反应: B、与NaOH溶液反应: C、明矾净水原理: D、与过量氨水反应:13. 实验室模仿氯碱工业用如下图所示装置(X、Y是碳棒)进行由解饱和食盐水的实验。通电之后,发现X、Y电极上均有气泡产生,其中Y电极上的气泡相对X电极更密,关于该实验的叙述正确的是 A、Y电极上发生还原反应 B、在两极滴加酚酞试剂,X电极附近溶液先变红 C、X电极上的气泡减少的主要原因是溶于水 D、Y电极连接的是电源正极14. 证明的酸性强于 , 所选装置(A~F中)的连接顺序为
A、Y电极上发生还原反应 B、在两极滴加酚酞试剂,X电极附近溶液先变红 C、X电极上的气泡减少的主要原因是溶于水 D、Y电极连接的是电源正极14. 证明的酸性强于 , 所选装置(A~F中)的连接顺序为 A、 B、 C、 D、15. 氨基钠()是重要的化学试剂,其与氧气的反应如下:。下列说法正确的是A、 B、每消耗 , 转移电子数是 C、是氧化产物 D、中N的化合价部分发生变化16. 在相同条件下研究催化剂Ⅰ、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图所示。下列说法正确的是
A、 B、 C、 D、15. 氨基钠()是重要的化学试剂,其与氧气的反应如下:。下列说法正确的是A、 B、每消耗 , 转移电子数是 C、是氧化产物 D、中N的化合价部分发生变化16. 在相同条件下研究催化剂Ⅰ、Ⅱ对反应的影响,各物质浓度c随反应时间t的部分变化曲线如图所示。下列说法正确的是 A、无催化剂时,反应不能进行 B、催化剂Ⅱ比催化剂Ⅰ效率更高 C、a曲线表示使用催化剂Ⅰ时A的浓度随t的变化 D、使用催化剂Ⅱ时,0~2min内,17. 氟他胺G是一种可用于治疗肿瘤的药物,其制备的部分合成路线如下(已知:吡啶是一种有机碱)。下列说法错误的是
A、无催化剂时,反应不能进行 B、催化剂Ⅱ比催化剂Ⅰ效率更高 C、a曲线表示使用催化剂Ⅰ时A的浓度随t的变化 D、使用催化剂Ⅱ时,0~2min内,17. 氟他胺G是一种可用于治疗肿瘤的药物,其制备的部分合成路线如下(已知:吡啶是一种有机碱)。下列说法错误的是 A、D中所有的碳原子均在同一平面上 B、吡啶的作用是吸收反应产生的HCl,提高反应转化率 C、E的分子式是 D、反应⑥的反应试剂和反应条件是浓硫酸、浓硝酸,加热18. 部分含氯物质的分类与相应氯元素的化合价关系如下图所示,下列说法正确的是
A、D中所有的碳原子均在同一平面上 B、吡啶的作用是吸收反应产生的HCl,提高反应转化率 C、E的分子式是 D、反应⑥的反应试剂和反应条件是浓硫酸、浓硝酸,加热18. 部分含氯物质的分类与相应氯元素的化合价关系如下图所示,下列说法正确的是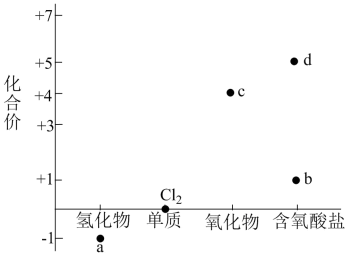 A、洁厕灵的主要成分为a,84消毒液的主要成分为b的一种,两者如果混用会产生有毒气体 B、c的化学式为 , 是HClO的酸酐 C、a的浓溶液可与d的溶液反应制备 D、新制氯水中存在如下平衡:19. 甲~戊均为短周期主族元素,在元素周期表中的相对位置如下图所示,戊的最高价氧化物对应的水化物为强酸,下列说法可能错误的是
A、洁厕灵的主要成分为a,84消毒液的主要成分为b的一种,两者如果混用会产生有毒气体 B、c的化学式为 , 是HClO的酸酐 C、a的浓溶液可与d的溶液反应制备 D、新制氯水中存在如下平衡:19. 甲~戊均为短周期主族元素,在元素周期表中的相对位置如下图所示,戊的最高价氧化物对应的水化物为强酸,下列说法可能错误的是甲
丁
乙
丙
戊
A、非金属性:丙<戊 B、单质的熔点:甲>乙 C、简单氢化物的稳定性:丁>戊 D、最外层电子数:乙<丙20. 下列现象与所述的化学知识没有关联的是选项
现象
化学知识
A
工厂将模具干燥后再注入熔融钢水
铁与水高温下会反应
B
开发高端耐腐蚀镀铝钢板
铝能形成致密氧化膜
C
石蜡油加强热产生的气体使溴水褪色
气体中含有饱和烃
D
氧化铝用于制作耐高温材料
氧化铝熔点高
A、A B、B C、C D、D二、非选择题
-
21.(1)、Ⅰ.氢气是重要的工业原料,煤的气化是一种重要的制氢途径。反应过程如下:
①
②
的结构式为 , C、H、O三种元素的原子半径由小到大的顺序为。
(2)、反应①的平衡常数表达式。(3)、Ⅱ.在一定温度下,向体积固定的密闭容器中加入足量和。反应平衡时,的转化率为50%,CO的物质的量为0.1mol。下列说法正确的是
a.将炭块粉碎,可加快反应速率
b.混合气体的密度保持不变时,说明反应体系已达到平衡
c.平衡时的体积分数可能大于
(4)、若平衡时向容器中充入惰性气体,容器内压强(选填“增大”“减小”或“不变”),反应①的(选填“增大”“减小”或“不变”),平衡 (选填“正向移动”“逆向移动”或“不移动”)。(5)、达到平衡时,整个体系(选填“吸收”或“放出”)热量kJ。22.(1)、Ⅰ.纯碱()和小苏打()都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下列方法中可行的是。
a.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
b.分别用干净铁丝蘸取样品在煤气灶的火焰上灼烧,观察火焰颜色
c.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
d.分别放在炒锅中加热,观察是否有残留物
(2)、溶液和溶液中都含有、、、、、、 , 写出一个用浓度表示这些微粒之间的电荷守恒的关系式。(3)、Ⅱ.某同学在两个相同的特制容器中分别加入溶液和溶液,再分别用盐酸滴定,利用pH计和压力传感器检测,得到如下曲线:
甲、乙两条线中表示向溶液中滴加盐酸的是 , 理由是。丙、丁两条线中表示向溶液中滴加盐酸的是 , 理由是。
(4)、当滴加盐酸的体积为时(a点、b点),所发生的反应用化学方程式表示为。根据图分析,滴定时c点可用、d点可用作指示剂指示滴定终点(选填“甲基橙”“石蕊”或“酚酞”)。(5)、NaClO也是生活中常见的钠的化合物。废水脱氮工艺中有一种方法是在废水中加入过量NaClO使完全转化为 , 该反应的离子方程式为。23. 8-羟基喹啉是一种重要的医药中间体,以下是它的合成路线。
已知:i.

ii.同一个碳原子上连有2个羟基的分子不稳定
(1)、A中含有的官能团名称是 , 反应⑦的反应类型是。(2)、反应②属于加成反应,写出C可能的结构简式。(3)、写出满足下列条件的K的一种同分异构体的结构简式。①能发生水解 ②不能与Na反应 ③能发生银镜反应 ④有4种化学环境不同的氢原子
(4)、将下列K→M的流程图补充完整。;(合成路线常用的表达方式为:目标产物)
 (5)、合成8-羟基喹咻时,M发生了(填“氧化”或“还原”)反应,反应时还生成了水,则M与G的物质的量之比为。24. 酸雨是全球三大环境危害之一,根据其所带的酸性物质不同,酸雨分为硫酸型酸雨和硝酸型酸雨。(1)、酸雨的标准是:降水的pH小于。(2)、写出硫酸型酸雨的形成过程(用化学方程式表示)。(3)、有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,具体流程如下:
(5)、合成8-羟基喹咻时,M发生了(填“氧化”或“还原”)反应,反应时还生成了水,则M与G的物质的量之比为。24. 酸雨是全球三大环境危害之一,根据其所带的酸性物质不同,酸雨分为硫酸型酸雨和硝酸型酸雨。(1)、酸雨的标准是:降水的pH小于。(2)、写出硫酸型酸雨的形成过程(用化学方程式表示)。(3)、有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,具体流程如下:
①写出装置C中反应的离子方程式。
②该流程中可以循环利用的物质是(填写化学式)。
(4)、还有学者提出利用、等离子的催化作用,常温下将氧化成而实现的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中氧化成的转化率。
①该小组采用下图装置在实验室测定模拟烟气中的体积分数,X溶液可以是(选填字母)。

a.碘的淀粉溶液 b.酸性高锰酸钾溶液 c.氢氧化钠溶液 d.氯化钡溶液
②若上述实验是在标准状况下进行的,欲测定转化器中氧化成的转化率。已知气体流速,还需测定的数据有、。