陕西省咸阳市2023届高三下学期模拟检测(二)理综化学试题
试卷更新日期:2023-04-03 类型:高考模拟
一、单选题
-
1. 化学与人类社会的生产、生活有着密切联系。下列叙述错误的是A、歼-20飞机上用到的氮化镓材料属于合金材料 B、“火树银花合,星桥铁锁开”,其中的“火树银花”涉及到焰色试验 C、维生素C具有还原性,可用作食品抗氧化剂 D、泡沫灭火器可用于一般的起火,但不适用于活泼金属引起的火灾2. 设NA表示阿伏加德罗常数的值。下列叙述正确的是A、92gN2O4含有的氮原子数目为NA B、1molAl变为Al3+时,失去的电子数目为3NA C、标准状况下,22.4L苯含有的分子数目为NA D、pH=1的盐酸溶液中含有H+的数目为0.1NA3. 含硫化合物的反应具有多样性。下列反应的离子方程式书写错误的是A、用Na2SO3溶液吸收SO2废气: B、海水提溴工艺中用SO2还原Br2: C、用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4(s)+(aq)⇌CaCO3(s)+(aq) D、用少量Na2S2O3溶液吸收水中的Cl2:4. 化合物()可帮助植物解除重金属中毒。W、X、Y、Z为原子序数依次增大的前20号元素。该化合物的热重曲线如图所示下列说法错误的是
 A、W、X、Y能形成多种酸 B、原子半径: C、左右热分解会产生有毒气体 D、热分解后生成固体化合物是ZY5. 某神经类药物的结构如图所示。下列说法正确的是
A、W、X、Y能形成多种酸 B、原子半径: C、左右热分解会产生有毒气体 D、热分解后生成固体化合物是ZY5. 某神经类药物的结构如图所示。下列说法正确的是 A、分子中存在2种含氧官能团 B、分子中最多有14个原子共平面 C、1mol该物质与足量H2反应,最多消耗7molH2 D、1mol该物质与足量NaOH溶液反应,最多消耗3molNaOH6. 下列实验操作能达到相应实验目的的是
A、分子中存在2种含氧官能团 B、分子中最多有14个原子共平面 C、1mol该物质与足量H2反应,最多消耗7molH2 D、1mol该物质与足量NaOH溶液反应,最多消耗3molNaOH6. 下列实验操作能达到相应实验目的的是选项
实验操作
实验目的
A
向肉桂醛(
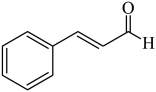 )中加入酸性溶液
)中加入酸性溶液验证肉桂醛中含碳碳双键
B
向待测液中先滴加氯水,再滴加KSCN溶液
检验溶液中是否含有
C
用pH试纸分别测定等浓度的溶液和NaClO溶液的pH
比较和HClO的酸性强弱
D
常温常压下,向两份相同锌粒中,分别加入体积相同、浓度不同的稀硫酸,记录收集相同体积所需的时间
探究浓度对化学反应速率的影响
A、A B、B C、C D、D7. 常温下,用0.1mol/L的NaOH溶液滴定20mL 0.1mol/L丙酮酸(CH3COCOOH)溶液,滴定过程中pH及电导率随加入NaOH溶液的体积变化曲线如图。下列说法正确的是 A、水的电离程度:b>c B、曲线Ⅱ为电导率曲线 C、b点溶液中: D、若a=1.7,则CH3COCOOH的电离常数Ka的数量级为10-2(已知)
A、水的电离程度:b>c B、曲线Ⅱ为电导率曲线 C、b点溶液中: D、若a=1.7,则CH3COCOOH的电离常数Ka的数量级为10-2(已知)二、非选择题
-
8. 废旧锌锰电池中的黑锰粉含有MnO2、MnO(OH)、NH4Cl和少量ZnCl2、Fe2O3及炭黑等,为了保护环境、充分利用锰资源,通过如下流程制备MnSO4。

回答下列问题:
(1)、Mn的原子结构示意图为。(2)、“滤液a”的主要成分为NH4Cl,另外还含有少量ZnCl2等。①用离子方程式表示“滤液a”呈酸性的原因。
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、、洗涤、干燥,得NH4Cl固体。
 (3)、“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为。(4)、探究“酸浸”中MnO2溶解的适宜操作。
(3)、“焙炒”的目的是除炭、氧化MnO(OH)等。空气中O2氧化MnO(OH)的化学方程式为。(4)、探究“酸浸”中MnO2溶解的适宜操作。实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
实验II.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是 , 实验II中H2O2的作用是。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是。
(5)、加入MnO调pH时,证明MnSO4溶液中Fe3+沉淀完全的实验步骤及现象:取少量溶液,滴加(填试剂),观察到(填现象)。9. 苯乙烯是生产塑料与合成橡胶的重要原料。氧化乙苯脱氢制苯乙烯的反应为:反应I:

已知:
反应II:
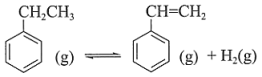
反应III:
回答下列问题:
(1)、反应I的。(2)、下列关于反应I~III的说法正确的是____(填标号)。A、及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 B、保持恒定时,说明反应I达到化学平衡状态 C、其他条件相同,反应II分别在恒容和恒压条件下进行,前者乙苯的平衡转化率更高 D、反应III正反应的活化能小于逆反应的活化能(3)、在催化剂作用下,氧化乙苯脱氢制苯乙烯可能存在如下图所示反应机理: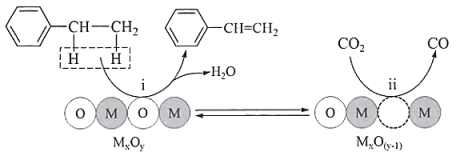
该机理可表示为以下两个基元反应,请补充反应ⅱ:
ⅰ:
 ;
;ⅱ:.
(4)、常压下,乙苯和经催化剂吸附后才能发生上述反应I。控制投料比[∶n(乙苯)]分别为1∶1、5∶1和10∶1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示: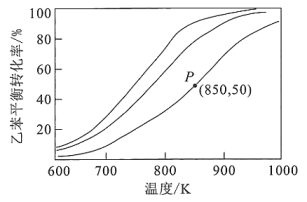
①乙苯平衡转化率相同时,投料比越高,对应的反应温度越(填“高”或“低”)。
②相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是:
ⅰ.乙苯的浓度过低;
ⅱ.。
③850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=。
(5)、700K时,向恒容密闭容器中加入过量和一定量乙苯,初始和平衡时容器内压强分别为和 , 则平衡时苯乙烯的分压为kPa(以含有、、p的代数式表示)。[已知:①混合气体中某组分的分压等于总压与该气体物质的量分数之积;以平衡分压代替平衡浓度进行计算,可得反应的分压平衡常数。② ]10. 二氯异氰尿酸钠(NaC3N3O3Cl2 , 摩尔质量为220g/mol)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。其制备原理为: , 请选择下列部分装置制备二氯异氰尿酸钠并探究其性质。
请回答下列问题:
(1)、选择合适装置,按气流从左至右,导管连接顺序为(填小写字母)。(2)、将D中试剂换成氯酸钾后发生反应的化学方程式为。(3)、仪器X中的试剂是。(4)、实验时,先向A中通入氯气,生成高浓度的NaClO溶液后,再加入氰尿酸溶液。在加入氰尿酸溶液后还要继续通入一定量的氯气,其原因是。(5)、反应结束后,A中浊液经过滤、、得到粗产品mg。(6)、粗产品中NaC3N3O3Cl2含量测定。将mg粗产品溶于无氧蒸馏水中配制成100mL溶液,取10.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用c mol/L Na2S2O3标准溶液进行滴定,加入淀粉指示剂,滴定至终点,消耗溶液。(假设杂质不与反应,涉及的反应为:C3N3O3Cl+3H++4I- = C3H3N3O3+2I2+2Cl- , )①滴定终点现象是。
②则NaC3N3O3Cl2的含量为。(用含m,c,V的代数式表示)
11. 据《自然》学术期刊显示,厦门大学教授郑南峰,与北京大学教授江颖课题组密切合作,提出了一种铜材料表面配位防腐技术,可实现各种尺度的铜材料抗氧化。Cu及其化合物应用广泛。回答下列问题:(1)、基态Cu原子电子排布式为(2)、磷化铜与水作用产生有毒的磷化氢(PH3)。①P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由:。
②P与N的氢化物空间构型相似,PH3键角NH3键角(填“>”“<"或“=”)。
(3)、胆矾(CuSO4·5H2O)为蓝色晶体,将其改写成配合物形式的化学式可书写成。其中配体的分子构型为 , 阴离子的中心原子杂化类型为 , S、O、H三种元素的电负性由大到小的顺序是; , 胆矾晶体中不包含的作用力有(填序号)。A.离子键 B.金属键 C.氢键 D.共价键 E.配位键
(4)、铜镍合金的立方晶胞结构如图所示:
已知原子O、A的分数坐标为(0,0,0)和(1,1,1),原子B的分数坐标为 , 若该晶体密度为dg·cm-3 , 则铜镍原子间最短距离为pm(列出计算式,设NA为阿伏加德罗常数的值)
12. 化合物E是合成某种抗肿瘤药物的重要中间体,其合成路线如下: (1)、化合物A中官能团的名称为硝基、和。(2)、B的结构简式为。(3)、C→D的反应类型为。(4)、写出化合物B同时符合下列条件的同分异构体的结构简式(至少写出3种)。
(1)、化合物A中官能团的名称为硝基、和。(2)、B的结构简式为。(3)、C→D的反应类型为。(4)、写出化合物B同时符合下列条件的同分异构体的结构简式(至少写出3种)。①存在-NO2与苯环直接相连,且不存在-O-O-键。
②不同化学环境的氢原子数目比为1:2:6。
(5)、写出以CH3CH2CHO和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。