山东省枣庄市2022-2023学年高三下学期二模考试化学试题
试卷更新日期:2023-04-03 类型:高考模拟
一、单选题
-
1. 二十大报告提出加快科技创新、构建新能源体系,推进生态优先、绿色低碳发展。下列说法错误的是A、“奋斗者”号深海载人潜水器采用的Ti62A新型钛合金材料硬度大、韧性好 B、推动大型风电、水电、太阳光伏等可再生能源发展 C、保护和治理山水林田湖草有利于实现碳中和 D、使用聚乙烯制作的塑料包装袋物美价廉,符合绿色低碳发展理念2. 下列关于物质使用及其解释均正确的是
选项
物质使用
解释
A
可用作净水剂
有氧化性
B
高纯硅用于光导纤维、太阳能电池、计算机芯片
硅具有半导体性能
C
液晶可作电视显示屏
液晶分子可沿电场方向有序排列
D
可用于钡餐
无毒
A、A B、B C、C D、D3. X、Y、Z、W均属于短周期元素,其中X、Y位于同一主族,Y、Z、W处于同一周期。X原子的最外层电子数是其电子层数的3倍,基态Z原子的电子总数是其最高能级电子数的5倍,同周期中W电负性最大。下列说法正确的是A、简单离子半径由小到大的顺序:X<Z<Y<W B、Y元素最高价氧化物对应水化物的化学式可表示为 C、上述元素形成的简单氢化物中X的氢化物沸点最高、最稳定 D、第一电离能:Z<Y<W<X4. 下列实验正确的是 A、图I:实验室制氨气 B、图II:石蜡催化分解 C、图III:制备氢氧化铁胶体 D、图IV:淀粉水解及产物检验5. 高分子N可用于制备聚合物离子导体,其合成路线如下:
A、图I:实验室制氨气 B、图II:石蜡催化分解 C、图III:制备氢氧化铁胶体 D、图IV:淀粉水解及产物检验5. 高分子N可用于制备聚合物离子导体,其合成路线如下:
下列说法正确的是
A、苯乙烯存在顺反异构体 B、试剂a为 C、试剂b为
D、反应1为加聚反应,反应2为缩聚反应
6. 碘在地壳中主要以形式存在,在海水中主要以形式存在,几种粒子之间的转化关系如图所示。下列说法正确的是
C、试剂b为
D、反应1为加聚反应,反应2为缩聚反应
6. 碘在地壳中主要以形式存在,在海水中主要以形式存在,几种粒子之间的转化关系如图所示。下列说法正确的是 A、由题图可知氧化性的强弱顺序: B、可利用与在一定条件下反应制备 C、途径III中若反应 , 则反应中转移电子 D、在淀粉碘化钾溶液中逐滴滴加氯水,不能观察到溶液变蓝现象7. 实验室模拟制备亚硝酰硫酸()的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是
A、由题图可知氧化性的强弱顺序: B、可利用与在一定条件下反应制备 C、途径III中若反应 , 则反应中转移电子 D、在淀粉碘化钾溶液中逐滴滴加氯水,不能观察到溶液变蓝现象7. 实验室模拟制备亚硝酰硫酸()的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是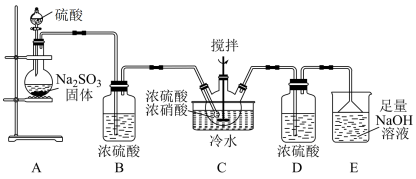 A、装置A中应使用70%的浓硫酸 B、装置B、D中浓硫酸作用不同 C、装置C中反应为 D、虚线框内的装置可以换为盛有碱石灰的干燥管8. 我国自主研发了对二甲苯绿色合成项目,合成过程如图所示。下列说法错误的是
A、装置A中应使用70%的浓硫酸 B、装置B、D中浓硫酸作用不同 C、装置C中反应为 D、虚线框内的装置可以换为盛有碱石灰的干燥管8. 我国自主研发了对二甲苯绿色合成项目,合成过程如图所示。下列说法错误的是 A、异戊二烯最多有11个原子共平面 B、可用溴水鉴别M和对二甲苯 C、该反应的副产物可能有间二甲苯 D、对二甲苯有6种二氯代物9. 高铁酸钾()具有杀菌消毒及净水作用,某实验小组在碱性条件下制备流程如图所示:
A、异戊二烯最多有11个原子共平面 B、可用溴水鉴别M和对二甲苯 C、该反应的副产物可能有间二甲苯 D、对二甲苯有6种二氯代物9. 高铁酸钾()具有杀菌消毒及净水作用,某实验小组在碱性条件下制备流程如图所示:
下列说法错误的是
A、消毒能力相当于1.5mol HClO B、氧化反应: C、同温度时高铁酸钠溶解度大于高铁酸钾 D、提纯时,应用到的玻璃仪器有蒸发皿、玻璃棒、烧杯、酒精灯10. 含Tp配体的钌(Ru)配合物催化氢化生成甲酸的机理如图所示:
下列叙述错误的是
A、循环中Ru的成键数目未发生变化 B、循环中氮和碳的杂化方式未发生改变 C、循环中物质所含氢键有分子间氢键和分子内氢键 D、循环的总反应为11. 下列实验操作不能达到实验目的的是选项
实验目的
实验操作
A
测定与混合物中碳酸钠质量分数
将固体溶于水配制成溶液,分别以酚酞和甲基橙为指示剂,用标准盐酸滴定
B
比较HClO与的酸性
用pH计测量相同浓度NaClO溶液和溶液的pH
C
提纯混有杂质的NaCl固体
将固体溶于水,蒸发浓缩,冷却结晶、过滤
D
比较、、的氧化性
向KBr、KI混合溶液中依次加入少量氯水和 , 振荡,静置
A、A B、B C、C D、D12. 以柏林绿新型可充电钠离子电池为电源,采用电解法在N-羟基邻苯二甲酰亚胺介质中用乙醇制乙醛。下列说法正确的是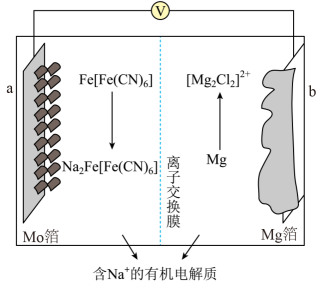
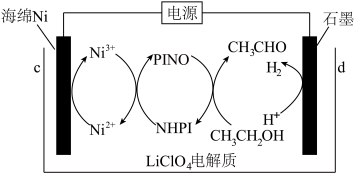 A、制备乙醛时a极连接c极 B、电池工作时溶液中移向b极 C、当有转化成时,生成 D、电源充分充电时,a极反应式为13. 砷化镓是一种立方晶系如图甲所示,将Mn掺杂到晶体中得到稀磁性半导体材料如图乙所示,砷化镓的晶胞参数为x pm,密度为。下列说法错误的是
A、制备乙醛时a极连接c极 B、电池工作时溶液中移向b极 C、当有转化成时,生成 D、电源充分充电时,a极反应式为13. 砷化镓是一种立方晶系如图甲所示,将Mn掺杂到晶体中得到稀磁性半导体材料如图乙所示,砷化镓的晶胞参数为x pm,密度为。下列说法错误的是
 A、砷化镓中配位键的数目是 B、Ga和As的最近距离是 C、沿体对角线a→b方向投影图如丙,若c在11处,则As的位置为7、9、11、13 D、Mn掺杂到砷化镓晶体中,和Mn最近且等距离的As的数目为614. 从钒铬锰矿渣(主要成分为、、MnO)中提取铬的一种工艺流程如图:
A、砷化镓中配位键的数目是 B、Ga和As的最近距离是 C、沿体对角线a→b方向投影图如丙,若c在11处,则As的位置为7、9、11、13 D、Mn掺杂到砷化镓晶体中,和Mn最近且等距离的As的数目为614. 从钒铬锰矿渣(主要成分为、、MnO)中提取铬的一种工艺流程如图:
已知:Mn(II)在酸性环境中较稳定,在碱性环境中易被氧化;在酸性溶液中钒通常以、等存在;沉铬过程中,当溶液时,开始出现沉淀,此时铬离子浓度为。下列说法正确的是
A、“沉钒”时,胶体的作用是吸附 B、滤液B的 , 沉铬完全 C、“提纯”过程中的作用是还原铬 D、“转化”过程中发生反应:15. 常温下,向1升的NaClO溶液中缓慢通入气体,使其充分吸收,溶液pH与通入的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是 A、常温下,HClO电离平衡常数的数量级为 B、a点溶液中: C、b点溶液中: D、c点溶液中:
A、常温下,HClO电离平衡常数的数量级为 B、a点溶液中: C、b点溶液中: D、c点溶液中:二、非选择题
-
16. Co元素的某些化合物在电池、光电材料、催化剂等方面有广泛应用。回答下列问题:(1)、一种具有光催化作用的配合物A结构简式如图所示:

①与Co同周期,基态原子有1个未成对电子的元素有种。
②配离子的空间构型为 , 钴元素价态为 , 通过整合作用形成的配位键有个。
③配合物A无顺磁性,则中心离子的杂化方式为(填标号)。(若中心离子具有单电子,则配合物为顺磁性物质。)
A. B. C. D.
④咪唑(
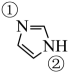 )具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。(2)、Co的一种化合物为六方晶系晶体,晶胞结构如图所。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。
)具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。(2)、Co的一种化合物为六方晶系晶体,晶胞结构如图所。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。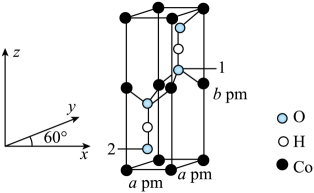
已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为。为阿伏加德罗常数的值,该晶体的密度为(用计算式表示)。
17. 钯(Pd)是一种贵金属,性质类似铂(Pt)。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭、及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图:
已知:I.阴、阳离子交换树脂的基本工作原理分别为、(表示树脂的有机成分)。
II.“沉钯”时得到氯钯酸铵固体,不溶于冷水,可溶于稀盐酸。
(1)、温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为。 (2)、“浸取”时,加入试剂A的目的为。(3)、“浸取”时,加入有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸()为二元强酸。加入浓盐酸和后主要反应的离子方程式:。(4)、“离子交换除杂”应使用(填“阳离子”或“阴离子”)树脂,“洗脱”时应使用的洗脱液为(填标号)。
(2)、“浸取”时,加入试剂A的目的为。(3)、“浸取”时,加入有利于Pd的溶解,生成的四氯合钯(Ⅱ)酸()为二元强酸。加入浓盐酸和后主要反应的离子方程式:。(4)、“离子交换除杂”应使用(填“阳离子”或“阴离子”)树脂,“洗脱”时应使用的洗脱液为(填标号)。A.硫酸 B.盐酸 C.无水乙醇
(5)、“还原”过程转化为 , 在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为 , 且该产物可循环利用至环节(填环节名称)。(6)、以上流程污染性较强且复杂,通常适用电解法回收钯。将“浸取”后的溶液与钯离子脱附试剂MH混合,形成配离子,电解可得高纯度钯,装置如图。电解时,当浓缩室里共得到的较浓盐酸时(体积变化忽略不计),理论上能得到Pdg,但实际生产中得不到相应质量的Pd,原因是。 18. 三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室可利用下面装置模拟制取三氯化铬(、为气流控制开关)。
18. 三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室可利用下面装置模拟制取三氯化铬(、为气流控制开关)。
原理:
已知:气体有毒,遇水发生水解产生两种酸性气体
(1)、实验装置合理的连接顺序为a—(填仪器接口字母标号)。(2)、步骤如下:i.连接装置,检查装置气密性,装入药品并通;
ii.加热反应管至400℃;
iii.控制开关,加热 , 温度保持在50℃~60℃之间;
iv.加热石英管继续升温至650℃,直到E中反应基本完成,切断管式炉的电源;
v.停止A装置水浴加热,……;
vi.装置冷却后,结束制备实验。
①步骤i中,开关、的状态分别为。
②补全步骤v的操作: , 其目的是。
(3)、从安全的角度考虑,整套装置的不足是。(4)、装置D中反应的离子方程式为。(5)、取三氯化铬样品0.300g,配制成250mL溶液。移取25.00mL于碘量瓶中,加热至沸腾后,加适量溶液,生成绿色沉淀。冷却后,加足量30% , 小火加热至绿色沉淀完全溶解。冷却后,加入酸化,再加入足量KI溶液,加塞摇匀充分反应后,铬元素只以存在,暗处静置5min后,加入指示剂,用标准溶液滴定至终点,消耗标准溶液21.00mL(杂质不参加反应)。
已知:;
①绿色沉淀完全溶解后,继续加热一段时间再进行后续操作,目的是。
②样品中无水三氯化铬的质量分数为(结果保留三位有效数字)。
③若将碘量瓶换为锥形瓶,则样品中无水三氯化铬质量分数的测量结果(填“偏高”、“偏低”或“无影响”)。
19. 利格列汀是一种抑制剂,为广大糖尿病患者提供了一种强效、安全及简便的治疗方案。其部分合成路线如图:
已知:i.
 (、、均为烃基)
(、、均为烃基)ii.
 (1)、B与氢气加成后得产物X,满足下列要求的X的同分异构体有(写结构简式)。
(1)、B与氢气加成后得产物X,满足下列要求的X的同分异构体有(写结构简式)。I.具有两性 II.两分子X间可形成六元环
(2)、A+B→C的反应方程式。(3)、H的结构简式为 , 反应①与反应②(填“可以”或“不可以”)交换顺序,原因是。(4)、下列关于F的说法中,正确的是(填标号)。a.为平面型分子 b.可以发生水解反应 c.分子中含结构
(5)、根据题目信息,写出以邻苯二胺( )和1-丙醇为主要原料(其它试剂自选)制备
)和1-丙醇为主要原料(其它试剂自选)制备 的合成路线。 20. 船舶柴油机发动机工作时,反应产生的尾气是空气主要污染物之一,研究的转化方法和机理具有重要意义。
的合成路线。 20. 船舶柴油机发动机工作时,反应产生的尾气是空气主要污染物之一,研究的转化方法和机理具有重要意义。已知:
(1)、氧化脱除NO的总反应是 。(2)、该反应过程有两步: , 反应中各物质浓度变化如图所示。则速率常数(填“>”、“<”或“≈”),原因是。 (3)、已知:的反应历程分两步:
(3)、已知:的反应历程分两步:步骤
反应
活化能
正反应速率方程
逆反应速率方程
I
(快)
II
(慢)
①则反应I与反应II的活化能:(填“>”“<”或“=”)。
反应的平衡常数(用、、、表示)。
②在400k、初始压强为的恒温刚性容器中,按通入NO和 , 一定条件下发生反应。达平衡时NO转化率为90%,转化率为40%。则的平衡常数(分压=总压×物质的量分数;理想气体状态方程 , )。
(4)、某研究小组将、和一定量的充入2L密闭容器中,在催化剂表面发生反应(),NO的转化率随温度的变化情况如图所示:
①5min内,温度从420K升高到580K,此时段内NO的平均反应速率(保留3位有效数字)。
②无氧条件下,NO生成的转化率较低,原因可能是。