辽宁省辽阳市2023届高三一模化学试题
试卷更新日期:2023-04-03 类型:高考模拟
一、单选题
-
1. 神舟十四号和神舟十五号六名航天员在轨驻留交换代表了我国天宫空间站将正式进入长期在轨运行阶段。下列叙述正确的是A、运载火箭加注的液氢燃料是高能清洁燃料 B、飞船返回舱表面的耐高温陶瓷材料属于金属材料 C、空间站舷窗使用的耐辐射石英玻璃的主要成分为硅 D、飞船逃逸系统复合材料中的酚醛树脂属于无机非金属材料2. 下列离子方程式书写错误的是A、在浊液中加入浓氨水得到深蓝色溶液: B、向溴水中滴加乙醛溶液,溶液酸性增强: C、向稀硝酸中加入少量粉末,溶液变蓝: D、向补血剂的溶液中滴加]溶液,产生蓝色沉淀:3. 设为阿伏加德罗常数的值,下列叙述正确的是
 A、中含有的配位键数为22NA B、铬晶胞如图所示,铬能切割成如图晶胞的数目为NA C、参与氧化还原反应时,转移的电子数一定为2NA D、溶液中含有的数为0.1NA4. 上海科研团队发现M是感知各种代谢活动的关键枢纽。M的结构如图所示。短周期主族元素R、Y、Z、X的原子半径依次减小,R为金属元素,X和R位于同主族,Y与R不同周期。下列叙述正确的是
A、中含有的配位键数为22NA B、铬晶胞如图所示,铬能切割成如图晶胞的数目为NA C、参与氧化还原反应时,转移的电子数一定为2NA D、溶液中含有的数为0.1NA4. 上海科研团队发现M是感知各种代谢活动的关键枢纽。M的结构如图所示。短周期主族元素R、Y、Z、X的原子半径依次减小,R为金属元素,X和R位于同主族,Y与R不同周期。下列叙述正确的是 A、简单离子半径: B、能与溶液反应 C、Z和R组成的化合物只含1种化学键 D、工业上电解熔融的制备的单质5. 《天工开物》中关于炼锌的记载:“凡倭铅(炼锌)古书本无之,乃近世所立名色。其质用炉甘石(主要成分是)熬炼而成。……每炉甘石十斤,装载入一泥罐内,封裹泥固以渐砑牙,勿使见火折裂。然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团,冷定毁罐取出。每十耗去其二,即倭铅也。”下列有关叙述错误的是A、我国古代积累了炼锌的生产技术 B、用该方法可以炼铝和铜等 C、炼锌过程中,煤作燃料和还原剂 D、“逐层用煤炭”可增大接触面积6. 某团队报道了单硫代内酯单体实现了坚韧可回收塑料的目的。反应原理如图所示(R为烃基)。
A、简单离子半径: B、能与溶液反应 C、Z和R组成的化合物只含1种化学键 D、工业上电解熔融的制备的单质5. 《天工开物》中关于炼锌的记载:“凡倭铅(炼锌)古书本无之,乃近世所立名色。其质用炉甘石(主要成分是)熬炼而成。……每炉甘石十斤,装载入一泥罐内,封裹泥固以渐砑牙,勿使见火折裂。然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团,冷定毁罐取出。每十耗去其二,即倭铅也。”下列有关叙述错误的是A、我国古代积累了炼锌的生产技术 B、用该方法可以炼铝和铜等 C、炼锌过程中,煤作燃料和还原剂 D、“逐层用煤炭”可增大接触面积6. 某团队报道了单硫代内酯单体实现了坚韧可回收塑料的目的。反应原理如图所示(R为烃基)。
下列叙述错误的是
A、聚合反应时,原子利用率为100% B、甲的水解产物均含有羟基 C、丙中杂化的原子只有碳原子 D、乙中碳氧双键活化了碳硫键7. 已知与焦性没食子酸(含)反应很快,利用下列装置不能达到实验目的的是 A、选择①装置制备氧气 B、选择②装置干燥和收集氧气 C、选择③装置探究焦性没食子酸(含)与氧气的反应 D、选择④装置分离和8. 染料敏化电池展现出广阔的应用前景,某染料敏化电池如图所示。下列说法错误的是
A、选择①装置制备氧气 B、选择②装置干燥和收集氧气 C、选择③装置探究焦性没食子酸(含)与氧气的反应 D、选择④装置分离和8. 染料敏化电池展现出广阔的应用前景,某染料敏化电池如图所示。下列说法错误的是已知:1个光子理论上可以转化为一个电子。
 A、电极为该电池的正极 B、该电池实现了太阳能转化为电能 C、该电池工作一段时间后需补充 D、若用该电池电解水,当光电转化效率为5%时,每分钟该电池接受光子,电解效率为80%,则10分钟后消耗的水的质量为9. 某课题组对羧基化研究取得很大的进展,历程如图所示。
A、电极为该电池的正极 B、该电池实现了太阳能转化为电能 C、该电池工作一段时间后需补充 D、若用该电池电解水,当光电转化效率为5%时,每分钟该电池接受光子,电解效率为80%,则10分钟后消耗的水的质量为9. 某课题组对羧基化研究取得很大的进展,历程如图所示。
已知:为烃基,Me为甲基。下列叙述正确的是
A、能降低总反应的活化能 B、物质1和物质A反应时,只断裂了键 C、物质2中为 D、转化为时,1个分子断裂了2个键10. 下列实验操作、现象和结论均正确的是选项
实验操作
现象
结论
A
在苯酚溶液中滴加少量溴水
没有明显现象
苯酚与溴不反应
B
在鸡蛋清溶液中加入饱和Ba(NO3)2溶液
有沉淀生成
蛋白质发生盐析
C
用pH计测定同浓度的NH4F溶液和NaClO溶液的pH
后者pH较大
D
在I2的CCl4溶液中加入浓KI溶液,振荡
四氯化碳层紫红色变浅
I2在四氯化碳中的溶解度小于在KI溶液中的溶解度
A、A B、B C、C D、D11. 一定条件下,向一恒容密闭容器中通入适量的和 , 发生反应: , 经历两步反应:①;②。反应体系中、、的浓度随时间的变化曲线如图所示。下列叙述正确的是 A、曲线a是随时间的变化曲线 B、时, C、时,的生成速率大于消耗速率 D、时,12. 一研发团队基于型异质结的、、的超痕量同时检测及其机理如图所示。下列叙述错误的是
A、曲线a是随时间的变化曲线 B、时, C、时,的生成速率大于消耗速率 D、时,12. 一研发团队基于型异质结的、、的超痕量同时检测及其机理如图所示。下列叙述错误的是 A、图中涉及的金属元素位于元素周期表d区 B、图中含金属的纯净物为单质或氧化物 C、上述涉及的四种金属元素均为过渡元素 D、炭粒在制备氧化物的过程中表现氧化性13. 光催化还原是一种有望在固碳和绿色能源领域应用的技术。水溶液中复合材料光催化还原为醇类的机理图如图,是电子跃迁后留下的空穴,具有强氧化性。下列说法错误的是
A、图中涉及的金属元素位于元素周期表d区 B、图中含金属的纯净物为单质或氧化物 C、上述涉及的四种金属元素均为过渡元素 D、炭粒在制备氧化物的过程中表现氧化性13. 光催化还原是一种有望在固碳和绿色能源领域应用的技术。水溶液中复合材料光催化还原为醇类的机理图如图,是电子跃迁后留下的空穴,具有强氧化性。下列说法错误的是 A、在富集空穴的材料上发生氧化反应 B、光催化还原在一定条件下也可以生成甲烷等有机物 C、光催化过程的总反应是和 D、材料上富集还原性强的光生电子将还原,当消耗标准状况下时,转移电子14. 我国科学家开发铜钯催化剂高效实现电催化还原制备乙酸,铜钯晶胞如图。已知:、的原子半径分别为a pm,b pm。下列叙述正确的是
A、在富集空穴的材料上发生氧化反应 B、光催化还原在一定条件下也可以生成甲烷等有机物 C、光催化过程的总反应是和 D、材料上富集还原性强的光生电子将还原,当消耗标准状况下时,转移电子14. 我国科学家开发铜钯催化剂高效实现电催化还原制备乙酸,铜钯晶胞如图。已知:、的原子半径分别为a pm,b pm。下列叙述正确的是 A、乙酸的同分异构体均易溶于水 B、该晶胞的化学式为 C、离最近的有8个 D、该晶体的密度15. 二元有机酸的电离常数、。难溶于水,常温下,将溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中与的关系如图所示。下列说法错误的是
A、乙酸的同分异构体均易溶于水 B、该晶胞的化学式为 C、离最近的有8个 D、该晶体的密度15. 二元有机酸的电离常数、。难溶于水,常温下,将溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中与的关系如图所示。下列说法错误的是
已知:HY是一元强酸,易溶于水。
A、溶液显碱性 B、溶度积 C、b点: D、若溶于HY溶液中得到点溶液,则二、非选择题
-
16. 介孔纳米晶可用作钠离子电池正极材料。一科研团队以某矿石(含55.2%、32% , 其余为和)为原料开发的一种合成介孔的路线如图所出示。回答下列问题:
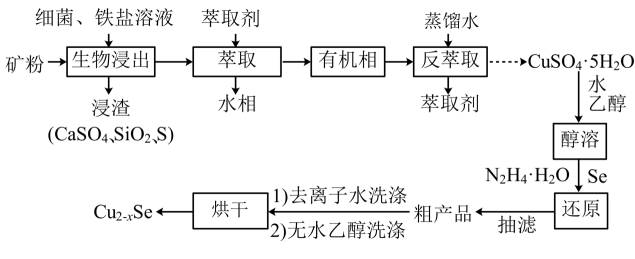 (1)、基态原子价电子的轨道表示式为。(2)、“生物浸出”时,与铁盐溶液反应的离子方程式为。此时铁盐(填“作氧化剂”、“作还原剂”或“既不是氧化剂,也不是还原剂”)。(3)、将“浸渣”溶于 , 再过滤、蒸馏,可从“浸渣”中分离出(填化学式)。(4)、实验室“萃取”时,用到的主要仪器是 , 若萃取剂为苯,“萃取”后得到的“水相”位于(填“上层”或“下层”)。(5)、利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是。
(1)、基态原子价电子的轨道表示式为。(2)、“生物浸出”时,与铁盐溶液反应的离子方程式为。此时铁盐(填“作氧化剂”、“作还原剂”或“既不是氧化剂,也不是还原剂”)。(3)、将“浸渣”溶于 , 再过滤、蒸馏,可从“浸渣”中分离出(填化学式)。(4)、实验室“萃取”时,用到的主要仪器是 , 若萃取剂为苯,“萃取”后得到的“水相”位于(填“上层”或“下层”)。(5)、利用如图1装置完成“抽滤”操作,抽滤的主要优点是过滤较快、固体较干燥,其中安全瓶的作用是。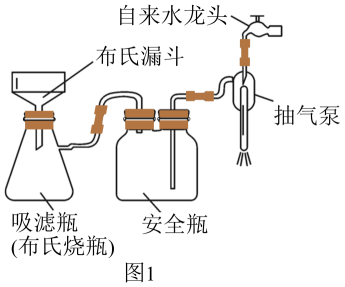 (6)、利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为。
(6)、利用如图2装置制备去离子水,水中所含的阴离子在阳离子交换柱中发生反应的离子方程式为。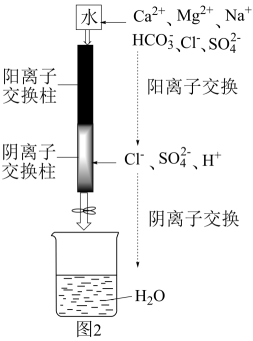 (7)、某工厂用10吨该矿石合成介孔 , 已知整个流程中的损耗率为10%, , 则最终可以得到。17. 化学链燃烧(CLC)是利用载氧体(OC)将空气中的氧传输至燃料的新技术,CLC原理如图所示。回答下列问题:
(7)、某工厂用10吨该矿石合成介孔 , 已知整个流程中的损耗率为10%, , 则最终可以得到。17. 化学链燃烧(CLC)是利用载氧体(OC)将空气中的氧传输至燃料的新技术,CLC原理如图所示。回答下列问题:
已知:①
②
(1)、 (用含、的代数式表示)。相对传统的燃烧方式,化学链燃烧的优点是 , 有助于实现碳达峰、碳中和目标。(2)、在密闭容器中加入足量的、和 , 在总压强保持不变的条件下,仅发生反应②,测得在不同温度下的平衡转化率与起始投料比的关系如图所示。
①其他条件不变,x的值增大,的平衡转化率减小的原因是。
②T1(填“>”、“<”或“=”)T2。
③T2℃时,该反应的平衡常数(只列计算式,不带单位)。提示:分压=总压×气体物质的量分数。
(3)、一定温度下,在恒压密闭容器中充入足量的、 , 仅发生反应②,达到平衡后,再充入少量 , 平衡(填“正向”、“逆向”或“不”)移动,再次达到平衡时,丁烷的平衡转化率(填“增大”、“减小”或“不变”)。18. 氯化氰 , 又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:
已知部分信息如下:
①CNCl的熔点为-6.5℃,沸点为13.1℃,可溶于水并与水反应;具有较强的还原性。
②合成原理:在℃条件下,。
(1)、所含元素中第一电离能最大的是(填元素符号),B的作用是。(2)、F中干冰和丙酮的作用是降低温度,此时干冰(填“升华”或“凝华”)。(3)、实验中,先向D中通入(填“”或“”)。(4)、D中温度高于-5℃时,与反应只生成和气体X(纯净物,其结构中不含环状结构),X的电子式为。当G中(填实验现象)时,停止通入。(5)、本实验在通风橱中进行且操作者佩戴防毒面具,原因是。向盛有溶液的试管中通入少量 , 然后滴加一滴溶液,溶液立即变为红色,和反应的离子方程式为。(6)、上述实验中,完全反应时收集到 , 产率为%(结果保留整数)。19. 诺氟沙星为第三代喹诺酮类抗菌药,会阻碍消化道内致病细菌的DNA旋转酶的作用,阻碍细菌DNA复制,对细菌有抑制作用,是治疗肠炎痢疾的常用药。但此药对未成年人骨骼形成有延缓作用,会影响发育,故禁止未成年人服用。一种合成诺氟沙星的路线如图所示。回答下列问题: (1)、诺氟沙星中含氧官能团的名称是。(2)、A→C的反应类型是。C→D中,另一产物是(填结构简式)。(3)、E→F的反应条件是。(4)、D→E的化学方程式为。(5)、在G的链状同分异构体中,同时具备下列条件的结构有种(不包括立体异构)。
(1)、诺氟沙星中含氧官能团的名称是。(2)、A→C的反应类型是。C→D中,另一产物是(填结构简式)。(3)、E→F的反应条件是。(4)、D→E的化学方程式为。(5)、在G的链状同分异构体中,同时具备下列条件的结构有种(不包括立体异构)。①含2个氨基。
②同一个碳原子上不连接2个氨基。
(6)、已知:硝基苯在铁粉和盐酸作用下被还原成苯胺。以苯、 为原料合成某药物中间体(
为原料合成某药物中间体( ),设计合成路线(无机试剂任选)。
),设计合成路线(无机试剂任选)。