广东省佛山市2023年中考一模化学试题
试卷更新日期:2023-04-03 类型:中考模拟
一、单选题
-
1. 下列涉及化学变化的是( )A、干冰升华 B、海水晒盐 C、燃放烟花 D、酒精挥发2. 节约用水,人人有则。下列图标属于“国家节水标志”的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列属于纯净物的是( )A、洁净空气 B、可口可乐 C、东平河水 D、液态氮气4. 下列实验操作一定正确的是( )A、点燃酒精灯
3. 下列属于纯净物的是( )A、洁净空气 B、可口可乐 C、东平河水 D、液态氮气4. 下列实验操作一定正确的是( )A、点燃酒精灯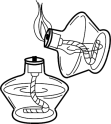 B、稀释浓硫酸
B、稀释浓硫酸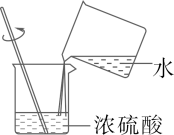 C、滴加液体药品
C、滴加液体药品 D、取用固体药品
D、取用固体药品 5. 下列物质属于空气污染物的是( )A、氮气 B、二氧化氮 C、氧气 D、二氧化碳6. 为我国纯碱(Na2CO3)工业的发展做出了杰出贡献的科学家是( )A、张青莲 B、侯德榜 C、屠呦呦 D、杨振宁7. 水是人类生命之源。下列说法错误的是( )A、水是由氢元素和氧元素组成的 B、生活污水应集中处理后再排放 C、加入肥皂水有泡沫多的是软水 D、在水中投入活性炭可软化硬水8. 新能源汽车常用锂电池供电,锂元素在元素周期表中的信息如图所示。下列说法正确的是( )
5. 下列物质属于空气污染物的是( )A、氮气 B、二氧化氮 C、氧气 D、二氧化碳6. 为我国纯碱(Na2CO3)工业的发展做出了杰出贡献的科学家是( )A、张青莲 B、侯德榜 C、屠呦呦 D、杨振宁7. 水是人类生命之源。下列说法错误的是( )A、水是由氢元素和氧元素组成的 B、生活污水应集中处理后再排放 C、加入肥皂水有泡沫多的是软水 D、在水中投入活性炭可软化硬水8. 新能源汽车常用锂电池供电,锂元素在元素周期表中的信息如图所示。下列说法正确的是( )
 A、锂元素的相对原子质量为6.941g B、锂原子中子数为3 C、锂元素是第二周期元素 D、锂是非金属元素9. 常见的四种化学肥料:①KNO3②K2SO4③NH4HCO3④Ca3(PO4)2 , 有关表述正确的是( )A、KNO3属于复合肥料 B、四种肥料都不溶于水 C、肥料施用越多,对植物生长越有利 D、②③④三种肥料对作物的作用相同10. 下列化学符号表示两个氧分子的是( )A、O2 B、2O2 C、2O D、2O2-11. 化学与生产生活密切相关,下列说法错误的是( )A、天然气是一种可再生能源 B、炒菜时油锅着火,用锅盖盖灭 C、碳酸氢铵(NH4HCO3)是一种氮肥 D、铁制品表面刷漆可防止生锈12. 推理是学习化学常用的思维方法,下列推理正确的是( )A、质子数相同的粒子都属于同种元素 B、有发光、放热现象的一定是燃烧 C、使紫色石蕊溶液变红的溶液一定呈酸性 D、催化剂在化学反应前后的质量和性质一定不变13. 根据下图,下列说法正确的是( )
A、锂元素的相对原子质量为6.941g B、锂原子中子数为3 C、锂元素是第二周期元素 D、锂是非金属元素9. 常见的四种化学肥料:①KNO3②K2SO4③NH4HCO3④Ca3(PO4)2 , 有关表述正确的是( )A、KNO3属于复合肥料 B、四种肥料都不溶于水 C、肥料施用越多,对植物生长越有利 D、②③④三种肥料对作物的作用相同10. 下列化学符号表示两个氧分子的是( )A、O2 B、2O2 C、2O D、2O2-11. 化学与生产生活密切相关,下列说法错误的是( )A、天然气是一种可再生能源 B、炒菜时油锅着火,用锅盖盖灭 C、碳酸氢铵(NH4HCO3)是一种氮肥 D、铁制品表面刷漆可防止生锈12. 推理是学习化学常用的思维方法,下列推理正确的是( )A、质子数相同的粒子都属于同种元素 B、有发光、放热现象的一定是燃烧 C、使紫色石蕊溶液变红的溶液一定呈酸性 D、催化剂在化学反应前后的质量和性质一定不变13. 根据下图,下列说法正确的是( ) A、KNO3的溶解度大于NaCl的溶解度 B、10℃时,KNO3的饱和溶液的溶质质量分数为20% C、20℃时,20gKNO3能完全溶于50g水 D、当KNO3中混有少量NaCl时,可用降温结晶的方法提纯KNO314. 鉴别、除杂是重要的实验技能。下列实验目的通过对应实验操作能达到的是( )
A、KNO3的溶解度大于NaCl的溶解度 B、10℃时,KNO3的饱和溶液的溶质质量分数为20% C、20℃时,20gKNO3能完全溶于50g水 D、当KNO3中混有少量NaCl时,可用降温结晶的方法提纯KNO314. 鉴别、除杂是重要的实验技能。下列实验目的通过对应实验操作能达到的是( )选项
实验目的
实验操作
A
鉴别黄铜与铜片
相互刻画
B
除去FeSO4溶液中的CuCl2
加足量铁粉,过滤
C
鉴别CO和CH4
分别点燃,观察火焰颜色
D
除去CaO中的CaCO3
加足量水、搅拌、过滤
A、A B、B C、C D、D15. 实验室制备并收集二氧化碳,按下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳气体随时间变化曲线如图所示,下列说法错误的是( )实验编号
药品
Ⅰ
块状大理石、10%、 H2SO4溶液
Ⅱ
块状大理石、7%、HCl溶液
Ⅲ
大理石粉末、7%、HCl溶液
 A、实验Ⅲ对应的如图变化曲线为甲 B、实验Ⅱ和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小 C、实验Ⅰ和Ⅱ对比,说明影响反应速率的因素是酸的浓度 D、实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的
A、实验Ⅲ对应的如图变化曲线为甲 B、实验Ⅱ和Ⅲ对比,说明影响反应速率的因素是固体的颗粒大小 C、实验Ⅰ和Ⅱ对比,说明影响反应速率的因素是酸的浓度 D、实验Ⅱ和Ⅲ完全反应后,产生二氧化碳的质量是相等的二、填空题
-
16. 2022年12月28日,佛山地铁3号线首通段顺利开通,标志着佛山轨道交通网络初步形成。请回答下列问题:
 (1)、列车车厢顶部用石墨做电弓是利用石黑具有良好的性。(2)、列车车厢采用合金作为其外壳是因为合金与纯金属相比,有许多优良性能,如:(写出1条即可)。(3)、列车车厢表面刷漆是为了防止金属 , 铁锈中关键成分是Fe2O3 , 该氧化物中铁原子与氧原子的质量比是。(4)、列车钢轨采用铝和氧化铁在高温下反应生成铁和氧化铝,实现无缝焊接,该反应的化学方程式为。17. 在“宏观一微观一符号”之间建立联系,是化学学科特有的思维方式。
(1)、列车车厢顶部用石墨做电弓是利用石黑具有良好的性。(2)、列车车厢采用合金作为其外壳是因为合金与纯金属相比,有许多优良性能,如:(写出1条即可)。(3)、列车车厢表面刷漆是为了防止金属 , 铁锈中关键成分是Fe2O3 , 该氧化物中铁原子与氧原子的质量比是。(4)、列车钢轨采用铝和氧化铁在高温下反应生成铁和氧化铝,实现无缝焊接,该反应的化学方程式为。17. 在“宏观一微观一符号”之间建立联系,是化学学科特有的思维方式。 (1)、如图1所示:
(1)、如图1所示:①该反应中涉及种氧化物。
②该反应的化学方程式为 , 反应前后涉及化合价改变的元素有种。
(2)、如图2所示:①从微观的角度分析,甲处应填入的离子符号为。
②从微观的角度说明该反应的实质是。若想证明两种物质是否恰好完全反应,可在反应后的溶液中加入适量的试剂,该试剂是(填字母)。
a.AgNO3溶液 b.酚酞溶液
c.石蕊溶液 d.Na2CO3溶液
三、综合题
-
18. 为培养学习化学的兴趣,教师向学生提供:大理石、氯酸钾(固体)、二氧化锰、双氧水溶液、稀硫酸、稀盐酸、氢氧化钠稀溶液、石蕊试剂、锌粒等,组织学生进一步掌握气体的制取和收集,请根据以下仪器(另有:胶头滴管、表面皿等仪器)完成下列相关的内容:
 (1)、实验室若用A装置制取氧气,反应的化学方程式为。(2)、写出仪器b的名称:。用B装置制备CO2需要用到的药品是:。(在提供的药品中选)(3)、实验室制取H2时,选用的发生装置最佳的是(填提供装置的下标字母)。收集氢气时若用F装置,则气流进入F装置的接口是:(填字母c或d);制备氢气的化学方程式是:。(4)、实验过程中不小心将稀硫酸和氢氧化钠溶液标签弄丢,如何用简单的化学方法检验?。19. 某学习小组利用锈蚀严重的废铜屑(铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】)为原料回收铜,分别采用下图的两种方案。请回答下列问题:
(1)、实验室若用A装置制取氧气,反应的化学方程式为。(2)、写出仪器b的名称:。用B装置制备CO2需要用到的药品是:。(在提供的药品中选)(3)、实验室制取H2时,选用的发生装置最佳的是(填提供装置的下标字母)。收集氢气时若用F装置,则气流进入F装置的接口是:(填字母c或d);制备氢气的化学方程式是:。(4)、实验过程中不小心将稀硫酸和氢氧化钠溶液标签弄丢,如何用简单的化学方法检验?。19. 某学习小组利用锈蚀严重的废铜屑(铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】)为原料回收铜,分别采用下图的两种方案。请回答下列问题:资料1:
资料2:回收铜的两种实验方案。
 (1)、方案一中步骤Ⅱ是利用了CO的性(填“氧化”或“还原”),生成的二氧化碳不能直接排放到空气中,需要将其回收后再与碳粉作用,又可以生成CO,写出该过程的化学反应方程式:。(2)、方案二中步骤Ⅲ、IV、V都涉及到的操作名称是 , 该操作所需的玻璃仪器有:玻璃棒、烧杯和。(3)、方案二中步骤IV加入过量铁粉的目的是 , 该反应是利用铁的金属活动性比铜的(填“强”或“弱”)。(4)、理论上两种方案获得铜的质量比较:方案一方案二(选填“>、=、<”)。(5)、下图为铜元素的价类转化二维图,写出D点对应物质的化学式。步骤IV实现的是E→点(填字母)的转化。
(1)、方案一中步骤Ⅱ是利用了CO的性(填“氧化”或“还原”),生成的二氧化碳不能直接排放到空气中,需要将其回收后再与碳粉作用,又可以生成CO,写出该过程的化学反应方程式:。(2)、方案二中步骤Ⅲ、IV、V都涉及到的操作名称是 , 该操作所需的玻璃仪器有:玻璃棒、烧杯和。(3)、方案二中步骤IV加入过量铁粉的目的是 , 该反应是利用铁的金属活动性比铜的(填“强”或“弱”)。(4)、理论上两种方案获得铜的质量比较:方案一方案二(选填“>、=、<”)。(5)、下图为铜元素的价类转化二维图,写出D点对应物质的化学式。步骤IV实现的是E→点(填字母)的转化。 20. 阅读下面科普短文。
20. 阅读下面科普短文。材料一:合成氨是人类科学技术上的一项重大突破,为化肥工业奠定了基础,如图是合成氨的工艺流程图:

材料二:科学家还发现氨气是一种清洁能源,在纯氧中可以完全燃烧,只生成水和氮气,使得液氨有望取代液氢成为新一代绿色能源。下表为氨气和氢气的部分信息:
表一
性质名称
颜色、气味
熔点/℃
沸点/℃
25℃水中溶解度/g·L-1
标况下密度/g·L-1
氨气
无色、刺激性
-77.7
-33
456
0.6942
氢气
无色、无味
-259.2
-253
0.0015
0.0899
请回答下列问题:
(1)、如上图,从空气中得到N2是利用液态空气中各成分的不同,上述流程中可以循环利用的物质是。(2)、下列有关氮气和氢气反应的催化剂的说法正确的是。a.化学反应前后其质量改变了
b.改变了生成物的质量
c.只是改变了化学反应速率
(3)、如图,按下列条件进行合成氨反应,若要达到氨含量达到40%,你建议工厂选用的合成氨环境条件是:____ A、300℃低压 B、500℃高压(4)、如表2,请写出氨气在纯氧中燃烧的化学方程式 , 氨气中氮元素的价态是:。(5)、如表2中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在(填序号)。
A、300℃低压 B、500℃高压(4)、如表2,请写出氨气在纯氧中燃烧的化学方程式 , 氨气中氮元素的价态是:。(5)、如表2中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在(填序号)。表2
物质
H2
N2
NH3
沸点
-252℃
-195.8℃
-33.5℃
①-252℃≤t<-33.5℃
②-252℃≤t<-195.8℃
③-195.8℃≤t<-33.5℃
21. 实验室用高锰酸钾制取氧气,并对相关物质进行回收。实验过程如图所示,根据以下流程回答下列问题:
资料1:
物质
高锰酸钾
锰酸钾
二氧化锰
溶解性
能溶于水
能溶于水
不溶于水
资料2:①锰酸钾溶于水溶液呈深绿色。②
(1)、该流程中无色气体A的化学式为。(2)、步骤加热至不再产生气体,则固体C的成分是。(3)、计算完全分解31.6g高锰酸钾可以生成无色气体A的质量(写出计算过程)。(4)、在下图中画出固体C中锰元素的质量与生成无色气体A的质量之间的关系曲线图,并进行必要的标注。 (5)、为提高浸取效率,增加MnO2的质量,固体C用需要用药剂x浸取一段时间后过滤、洗涤、烘干即得MnO2。则药剂x是:。(填写字母)
(5)、为提高浸取效率,增加MnO2的质量,固体C用需要用药剂x浸取一段时间后过滤、洗涤、烘干即得MnO2。则药剂x是:。(填写字母)a.稀硫酸 b.水 c.NaOH溶液