江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题
试卷更新日期:2023-03-31 类型:高考模拟
一、单选题
-
1. “神舟飞船”接力腾飞、“太空之家”遨游苍穹、“福建号”航母下水、国产“C919”大飞机正式交付都彰显了中国力量。下列成果所涉及的材料为金属材料的是A、“神舟十五”号飞船使用的耐辐照光学窗材料——石英玻璃 B、“天宫”空间站使用的太阳能电池板材料——砷化镓 C、“福建号”航母使用的高强度甲板材料——合金钢 D、“C919”大飞机使用的机身复合材料——碳纤维和环氧树脂2. 用NaCN溶液浸取矿粉中金的反应为4Au+2H2O+8NaCN+O2=4Na[Au(CN)2]+4NaOH。下列说法正确的是A、H2O的空间结构为直线形 B、NaCN中含有离子键和共价键 C、1mol[Au(CN)2]-中含有2molσ键 D、NaOH的电子式为
 3. 由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4SiH4↑+LiCl+AlCl3。下列说法正确的是A、热稳定性:HCl>SiH4 B、离子半径:r(Li+)>r(H-) C、第一电离能:I1(Al)>I1(Cl) D、共价键的极性:Si-Cl>Al-Cl4. 用如图所示装置制备氨气并验证氨气的还原性,其中不能达到实验目的的是
3. 由SiCl4制备高纯SiH4的反应为SiCl4+LiAlH4SiH4↑+LiCl+AlCl3。下列说法正确的是A、热稳定性:HCl>SiH4 B、离子半径:r(Li+)>r(H-) C、第一电离能:I1(Al)>I1(Cl) D、共价键的极性:Si-Cl>Al-Cl4. 用如图所示装置制备氨气并验证氨气的还原性,其中不能达到实验目的的是 A、用装置甲生成氨气 B、用装置乙干燥氨气 C、用装置丙验证氨气的还原性 D、用装置丁和戊分别收集氨气和氮气5. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列说法正确的是A、基态氧原子价电子的轨道表示式为
A、用装置甲生成氨气 B、用装置乙干燥氨气 C、用装置丙验证氨气的还原性 D、用装置丁和戊分别收集氨气和氮气5. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列说法正确的是A、基态氧原子价电子的轨道表示式为 B、斜方硫和单斜硫互为同素异形体
C、SO2是由极性键构成的非极性分子
D、SeO2分子中O-Se-O的键角大于120°
6. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列化学反应表示错误的是A、碱性氢氧燃料电池放电时的正极反应:O2+2H2O+4e-=4OH- B、斜方硫的燃烧:S(s,斜方硫)+O2(g)=SO2(g) △H=297kJ•mol-1 C、煅烧黄铁矿获得SO2:4FeS2+11O28SO2+2Fe2O3 D、SO2与SeO2的水溶液反应制备硒:2SO2+SeO2+2H2O=Se↓+2H2SO47. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列物质性质与用途具有对应关系的是A、臭氧有强氧化性,可用于水体杀菌消毒 B、浓硫酸有脱水性,可用于干燥某些气体 C、二氧化硫有还原性,可用于织物的漂白 D、硒单质难溶于水,可用于制造硒光电池8. 一种电解法制备Na2FeO4的装置如图所示。下列说法正确的是
B、斜方硫和单斜硫互为同素异形体
C、SO2是由极性键构成的非极性分子
D、SeO2分子中O-Se-O的键角大于120°
6. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列化学反应表示错误的是A、碱性氢氧燃料电池放电时的正极反应:O2+2H2O+4e-=4OH- B、斜方硫的燃烧:S(s,斜方硫)+O2(g)=SO2(g) △H=297kJ•mol-1 C、煅烧黄铁矿获得SO2:4FeS2+11O28SO2+2Fe2O3 D、SO2与SeO2的水溶液反应制备硒:2SO2+SeO2+2H2O=Se↓+2H2SO47. 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如斜方硫(燃烧热为297kJ•mol-1)、单斜硫等,硫或黄铁矿(FeS2)制得的SO2可用来生产H2SO4。用SO2与SeO2的水溶液反应可制备硒;硒是一种半导体材料,在光照下导电性可提高近千倍。下列物质性质与用途具有对应关系的是A、臭氧有强氧化性,可用于水体杀菌消毒 B、浓硫酸有脱水性,可用于干燥某些气体 C、二氧化硫有还原性,可用于织物的漂白 D、硒单质难溶于水,可用于制造硒光电池8. 一种电解法制备Na2FeO4的装置如图所示。下列说法正确的是 A、电解时化学能转化为电能 B、电解时应将铂电极与直流电源正极相连 C、电解过程中转移2mole- , 理论上可获得标准状况下的H211.2L D、电解时铁电极反应式:Fe-6e-+8OH-=FeO+4H2O9. 化工原料Z是X与HI反应的主产物,X→Z的反应机理如图:
A、电解时化学能转化为电能 B、电解时应将铂电极与直流电源正极相连 C、电解过程中转移2mole- , 理论上可获得标准状况下的H211.2L D、电解时铁电极反应式:Fe-6e-+8OH-=FeO+4H2O9. 化工原料Z是X与HI反应的主产物,X→Z的反应机理如图:
下列说法正确的是
A、X分子中所有碳原子位于同一平面上 B、Y与Z中碳原子杂化轨道类型相同 C、X与Z分子中均含有1个手性碳原子 D、X与HI反应有副产物CH3CH2CH2CH2I产生10. 反应2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH<0可用于处理汽车尾气。下列说法正确的是A、该反应在任何温度下都能自发进行 B、上述反应平衡常数K= C、其他条件相同,增大体系压强,能提高NO的平衡转化率 D、其他条件相同,提高c(CO),正反应速率加快,逆反应速率减慢11. 以一定浓度NaOH溶液吸收H2S可制备Na2S或NaHS。若通入H2S所引起的溶液体积变化和H2O挥发可忽略,溶液中含硫物种的浓度c总=c(H2S)+c(HS-)+c(S2-)。室温下,H2S的电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。下列说法正确的是A、Na2S溶液显碱性的原因:S2-+2H2OH2S+2OH- B、NaOH恰好转化为Na2S的溶液中:c(OH-)=c(H+)+c(HS-)+c(S2-) C、吸收所得c总=c(Na+)的溶液中:c(H2S)>c(S2-) D、NaOH溶液吸收H2S过程中,溶液的温度下降12. 下列实验探究方案不能达到探究目的的是选项
探究方案
探究目的
A
向试管中滴入几滴1-溴丁烷,再加入2mL5%NaOH溶液,振荡后加热,反应一段时间后停止加热,静置。取数滴水层溶液于试管中,加入几滴2%AgNO3溶液,观察现象
检验1-溴丁烷中的溴元素
B
向盛有4mL0.1mol•L-1KBr溶液的试管中加入1mL新制氯水,振荡,观察溶液颜色变化
Cl2的氧化性比Br2强
C
室温下,比较等物质的量浓度的NaF溶液和NaClO溶液pH的相对大小
Ka(HF)>Ka(HClO)
D
向盛有5mL0.005mol•L-1FeCl3溶液的试管中加入5mL0.015mol•L-1KSCN溶液,再加入少量铁粉,振荡,观察溶液颜色变化
反应物浓度影响化学平衡
A、A B、B C、C D、D13. 以乙炔和1,2-二氯乙烷为原料生产氯乙烯包括如下反应:反应I:ClCH2CH2Cl(g)→HCl(g)+CH2=CHCl(g) ΔH1=+69.7 kJ•mol-1
反应Ⅱ:HC≡CH(g)+HCl(g)→CH2=CHCl(g) ΔH2=-98.8 kJ•mol-1
1.0×105Pa下,分别用如表三种方式进行投料,不同温度下反应达到平衡时相关数据如图所示。方式
气体投料
平衡时相关数据
甲
ClCH2CH2Cl
ClCH2CH2Cl转化率
乙
n(HC≡CH):n(HCl)=1:1
HC≡CH转化率
丙
n(ClCH2CH2Cl):n(HC≡CH)=1:1
CH2=CHCl产率

下列说法错误的是
A、反应ClCH2CH2Cl(g)+HC≡CH(g)→2CH2=CHCl(g)的ΔH=-29.1 kJ•mol-1 B、曲线①表示平衡时ClCH2CH2Cl转化率随温度的变化 C、按方式丙投料,其他条件不变,移去部分CH2=CHCl可能使CH2=CHCl的产率从X点的值升至Y点的值 D、在催化剂作用下按方式丙投料,反应达到平衡时CH2=CHCl的产率(图中Z点)低于X点的原因可能是催化剂活性降低二、非选择题
-
14. 以粉煤灰浸取液(含Al3+、Li+、Mg2+、Cl-等)为原料制备电极材料LiFePO4的实验流程如图:
 (1)、“焙烧”过程中AlCl3最终转化为Al2O3和(填化学式)。(2)、“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。已知Ksp[Mg(OH)2]=5.5×10-12 , 欲使c(Mg2+)≤5.5×10-6mol•L-1 , “除杂”需要调节溶液的pH不低于。(3)、离子筛法“富集”锂的原理如图1所示。在碱性条件下,离子筛吸附Li+容量较大,其可能原因为。
(1)、“焙烧”过程中AlCl3最终转化为Al2O3和(填化学式)。(2)、“浸出”后的滤液中主要含Li+、Mg2+、Cl-等。已知Ksp[Mg(OH)2]=5.5×10-12 , 欲使c(Mg2+)≤5.5×10-6mol•L-1 , “除杂”需要调节溶液的pH不低于。(3)、离子筛法“富集”锂的原理如图1所示。在碱性条件下,离子筛吸附Li+容量较大,其可能原因为。 (4)、已知Li2CO3的溶解度曲线如图2所示。“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有。
(4)、已知Li2CO3的溶解度曲线如图2所示。“沉锂”反应1h,测得Li+沉淀率随温度升高而增加,其原因有。 (5)、“合成”在高温下进行,其化学方程式为。(6)、LiFePO4的晶胞结构示意图如图3所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有个。
(5)、“合成”在高温下进行,其化学方程式为。(6)、LiFePO4的晶胞结构示意图如图3所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有个。 15. 化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如图:
15. 化合物E是合成降糖药瑞格列净的重要中间体,其合成路线如图: (1)、A→B的反应类型为。(2)、相同条件下,B的沸点比A的高,其主要原因是。(3)、B→C的反应中有副产物X(C7H7OBr)生成,X的结构简式为。(4)、D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。
(1)、A→B的反应类型为。(2)、相同条件下,B的沸点比A的高,其主要原因是。(3)、B→C的反应中有副产物X(C7H7OBr)生成,X的结构简式为。(4)、D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。①分子中含有苯环,且只含有两种不同化学环境的氢原子;
②1mol该物质与NaOH溶液反应,最多消耗4molNaOH。
(5)、已知:
 +CO2↑。写出以
+CO2↑。写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 16. 硫酸亚铁晶体(FeSO4•7H2O)可用于生产聚合硫酸铁。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体的实验流程如图:
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 16. 硫酸亚铁晶体(FeSO4•7H2O)可用于生产聚合硫酸铁。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体的实验流程如图: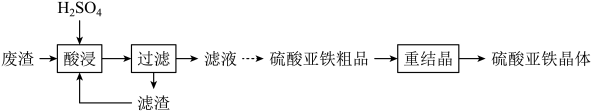 (1)、“酸浸”时,Fe3O4发生反应的离子方程式为。(2)、将“滤渣”返回“酸浸”工序,其目的是。(3)、与普通过滤相比,使用图1装置进行过滤的优点是。
(1)、“酸浸”时,Fe3O4发生反应的离子方程式为。(2)、将“滤渣”返回“酸浸”工序,其目的是。(3)、与普通过滤相比,使用图1装置进行过滤的优点是。 (4)、固定其他条件不变,反应温度、反应时间、铁粉过量系数[]分别对“滤液”中Fe3+还原率的影响如图2、图3、图4所示。
(4)、固定其他条件不变,反应温度、反应时间、铁粉过量系数[]分别对“滤液”中Fe3+还原率的影响如图2、图3、图4所示。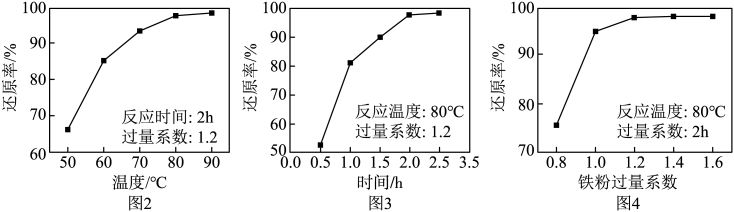
设计由100mL“滤液”[其中c(Fe3+)=0.8mol•L-1]制备硫酸亚铁粗品的实验方案:。(须使用的试剂和仪器:铁粉、冰水、真空蒸发仪)
(5)、通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000g样品置于锥形瓶中,用50mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000mol•L-1KMnO4标准溶液滴定至终点(MnO转化为Mn2+),平行滴定3次,平均消耗KMnO4标准溶液42.90mL。计算硫酸亚铁晶体样品中FeSO4•7H2O的质量分数。(写出计算过程)17. 苯乙烯是合成橡胶和塑料的重要原料,可由乙苯为原料制得。(1)、利用“乙苯脱氢反应”可制备苯乙烯。C6H5C2H5(g)C6H5CH=CH2(g)+H2(g) ΔH=akJ•mol-1
保持气体总压不变,原料气按以下A、B、C三种投料方式进行:
A.乙苯
B.n(乙苯):n(N2)=1:10
C.n(乙苯):n(CO2)=1:10
三种投料分别达到平衡时,乙苯转化为苯乙烯的转化率[×100%]与温度的关系如图1所示。

①α0(填“>”、“<”或“不能确定”)。
②相同温度下,投料方式B乙苯的平衡转化率比投料方式A的高,其原因是。
③相同温度下,投料方式C乙苯的平衡转化率比投料方式B的高,其可能原因是。
④工业上利用“乙苯脱氢反应”生产苯乙烯时,会产生少量积碳。使用相同条件下的水蒸气代替N2 , 可较长时间内保持催化剂的催化活性,其原因是。
(2)、CO2用于制备苯乙烯有助于实现“碳中和”。①在催化剂X作用下,CO2参与反应的机理如图2所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。根据元素电负性的变化规律,图2所示的反应机理中步骤I和步骤II可描述为。

②保持混合气体总压(p)等其他条件不变,CO2的分压[p(CO2)=×p]与乙苯转化率的关系如图3所示。p(CO2)>14kPa时,乙苯转化率下降的原因是。
