河南省许昌、济源、洛阳、平顶山四市2023届高三下学期第三次质量检测理科综合化学试题
试卷更新日期:2023-03-31 类型:高考模拟
一、单选题
-
1. 化学与科技、生活有密切的关系。下列叙述错误的是A、航空航天工业中采用化学镀镍,电镀时镀件作阴极,镍作阳极 B、我国力争2060年前实现碳中和,用脱硫煤代替原煤作燃料有利于实现碳中和 C、新冠疫情期间使用的抗原检测试纸,其检测原理是有机物分离方法中的层析法 D、卡塔尔世界杯旗帜来自中国制造,其主要材质是透风性好、不易损坏的涤纶
-
2. 某药物(如图所示)可辅助治疗新型冠状病毒,有关该药物的说法错误的是
 A、该物质具有多种芳香族同分异构体 B、分子中能发生酯化反应的官能团有3个 C、分子中所有碳原子可能处于同一平面上 D、1mol该物质最多能与4molH₂发生加成反应
A、该物质具有多种芳香族同分异构体 B、分子中能发生酯化反应的官能团有3个 C、分子中所有碳原子可能处于同一平面上 D、1mol该物质最多能与4molH₂发生加成反应 -
3. 与下列实验操作和现象所对应的原理解释正确的是
实验操作
现象
原理解释
A
向ZnS沉淀上滴加适量0.1mol/LCuSO4溶液,振荡试管
沉淀变为黑色
Kap(ZnS)>Kap(CuS)
B
将乙醇与浓硫酸混合加热产生的气体通入酸性KMnO4溶液中
溶液紫红色褪去
乙醇分子内脱水生成乙烯,乙烯具有还原性
C
向植物油中加入Na2CO3溶液,加热
溶液不再分层
碳酸钠溶液呈碱性:+2H2OH2CO3+2OHˉ,油脂在碱性条件下水解
D
实验室中加热KClO3和MnO2固体混合物制氧气
反应前后MnO2的质量没有发生变化
MnO2没有参与反应
A、A B、B C、C D、D -
4. 哈伯在实验室首次合成了氨,化学家格哈德·埃特尔在哈伯研究所证实了N2与H2在固体催化剂表面合成氨的反应过程。示意图如下:

下列说法正确的是
A、图①可看出N2、H2分子中均为单键 B、图③到图④的过程向外释放能量 C、升高温度一定提高一段时间内NH3的产率 D、工业合成氨过程中为提高产率压强越大越好 -
5. 某化合物(结构如图所示)是一种家用杀虫剂。X、Y、Z、W、R为原子序数逐渐增大的短周期元素,Z与R不在同一周期。下列叙述正确的是
 A、Z、W的氢化物均很稳定 B、阴离子的还原性:R>X C、W、R两种元素均可形成能使品红溶液褪色的化合物,且褪色原理相同 D、元素Y与元素R均能形成三种以上的含氧酸盐
A、Z、W的氢化物均很稳定 B、阴离子的还原性:R>X C、W、R两种元素均可形成能使品红溶液褪色的化合物,且褪色原理相同 D、元素Y与元素R均能形成三种以上的含氧酸盐 -
6. 环氧乙烷(
 , 简称EO)是一种重要的有机合成原料和高效消毒剂。由乙烯经电解制备EO的原理示意图如下:
, 简称EO)是一种重要的有机合成原料和高效消毒剂。由乙烯经电解制备EO的原理示意图如下:
下列说法正确的是
A、电极b接电源的正极 B、电极a发生反应为:CH2=CH2+H2O+Cl⁻+2e⁻=HOCH2CH2Cl+H+ C、该过程的总反应为:CH2=CH2+H2O +H2
D、当电路中转移2mol电子时,有22.4LCH2=CH2在阳极区发生反应
+H2
D、当电路中转移2mol电子时,有22.4LCH2=CH2在阳极区发生反应
-
7. 室温下某湖水中几种微粒的浓度与pH的关系如下图所示。已知水中现存的CO₂以H2CO₃形式计算作数据近似处理。下列说法错误的是
 A、室温下的水解常数Kh=10-7.7 B、向交点②所示的溶液中通入少量HCl气体可变为交点① C、交点③对应溶液pH≈5.65 D、上述溶液室温下pH=8.3时:c()>c(OH-)>c()
A、室温下的水解常数Kh=10-7.7 B、向交点②所示的溶液中通入少量HCl气体可变为交点① C、交点③对应溶液pH≈5.65 D、上述溶液室温下pH=8.3时:c()>c(OH-)>c()
二、非选择题
-
8. 三氯化氧磷(POCl₃)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。研究小组在实验室模拟反应CPCl3+SO2+Cl2POCl3+SOCl2 , 制备POCl3并测定产品的含量。

资料卡片:
物质
熔点/℃
沸点/℃
有关性质
PCl₃
-93.6
76.1
遇水剧烈水解,易与O₂反应
POCl₃
1.25
105.8
遇水剧烈水解,能溶于PCl₃
SOCl₂
-105
78.8
遇水剧烈水解,受热易分解
(1)、甲装置中盛放的试剂为 , 洗气瓶甲、丁的作用是净化原料气体和 , 实验室制备SO₂的化学方程式为。(2)、反应装置图中装置丙、戊间方框内未画出的仪器应选择(填“球形冷凝管”或“直形冷凝管”),如果没有装置戊,可能发生的反应是(写一个即可)。(3)、该实验需控制反应温度60-65℃,则温度不宜过高和过低的原因是 , 该实验应采用的加热方式为。(4)、测定提纯后产品中POCl₃的含量:准确称取1.700g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mol·L⁻¹的AgNO₃溶液20.00mL(发生的反应为Ag⁺+Cl⁻=AgCl↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入指示剂,用0.1000mol·L⁻¹KSCN标准溶液滴定过量的AgNO₃至终点(Ag⁺+SCN⁻=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。①滴定选用的指示剂是(填标号)。
a.酚酞 b.淀粉 c.NH₄Fe(SO4)2 d.甲基橙
②产品中POCl₃的质量分数为%(保留三位有效数字)。
③已知:Ksp(AgCl)=3.2×10⁻10 , Ksp(AgSCN)=2×10⁻¹²,若无硝基苯覆盖沉淀表面,测定产品中POCl₃的质量分数将(填“偏大”“偏小”或“无影响”)。
-
9. 某工厂利用如下流程处理废旧电池正极材料(主要成分为LiCoO₂、LiMn₂O₄、LiNiO₂、LiFePO₄等),制备三元锂电池正极材料LiNi1/3Mn1/3Co1/3O2。

回答下列问题:
(1)、为提高原料利用率,在“酸浸”步骤可采取的措施有(至少写两条)。(2)、“酸浸”中H₂O₂既表现还原性,又表现氧化性,则酸浸后的滤液中含有的金属阳离子有Ni²⁺、Mn²⁺、Co²⁺和 , “酸浸”中LiCoO₂发生反应的离子方程式为。(3)、“酸浸”中控制溶液的温度未发生较大变化,但双氧水消耗量仍超过理论用量,其可能原因是。(4)、“调pH”的目的是 , 部分离子浓度及对应氢氧化物的Ksp , 如下表,则“调pH”时pH不应超过。离子
浓度(mol·L⁻¹)
氢氧化物Ksp
Ni²⁺
1.00
1.00×10-15.2
Co²⁺
1.00
1.00×10-14.2
Mn²⁺
1.40
1.00×10-12.7
(5)、若“调pH”过程中,Ni²⁺、Mn²⁺、Co²⁺浓度不变,则“调浓度”过程需要向溶液中添加的X为(填标号)。a.NiSO₄ b.CoSO₄ c.MnSO₄ d.H₂SO₄
(6)、Ni1/3Mn1/3Co1/3(OH)2与Li₂CO₃焙烧生成LiNi1/3Mn1/3Co1/3O2的反应中,另一种反应物是。 -
10. 为加快实现“双碳”目标,有效应对全球气候变化、构建低碳社会,CO₂资源化利用受到越来越多的关注。(1)、I.Sabatier反应可实现CO₂甲烷化:
反应1 CO₂(g)+4H₂(g) CH₄(g)+2H₂O(g) ΔH=-165kJ⋅mol⁻¹
同时还发生的反应如下:
反应2 CO₂(g)+H₂(g) CO(g)+H₂O(g) ΔH=+41kJ⋅mol⁻¹
已知键能是指气态原子形成1mol化学键释放的能量,上述反应中相关的化学键键能数据如下:
化学键
O-H
C-H
C=O
H-H
键能/(kJ·mol⁻¹)
463
414
802
436
则C(g)+O(g)=CO(g) ΔH=kJ⋅mol⁻¹。
(2)、向某恒压密闭容器中充入5molCO₂和20molH₂,在不同温度下达到平衡时各含碳元素物质的物质的量n(X)与温度T的关系如下图所示。
①当反应1和反应2均达到化学平衡状态时,维持温度不变,增大容器体积,则反应2的平衡移动方向(填“正向移动”“逆向移动”或“不移动”),反应2的平衡常数(填“增大”“减小”或“不变”)。
②曲线Y表示的是(填含碳元素物质的化学式)的物质的量与温度的关系,曲线Z所表示的物质在800K~1100K之间物质的量增大的原因是。
③800K时,反应2的压强平衡常数Kp=(计算结果保留两位有效数字,用分压代替浓度,分压=物质的量分数×总压)。
(3)、 Ⅱ.一种从高炉气回收CO₂制储氢物质HCOOH的综合利用示意图如下:
铂电极上生成HCOOH的电极反应式为;电解过程中还伴随着析氢反应,若生成HCOOH的电解效率为80%,当电路中转移1mole⁻时,阴极室溶液的质量增加g(CO₂溶解量不计)[B的电解效率=]。
-
11. 2022年诺贝尔化学奖授予美国科学家卡罗琳·贝尔托齐、卡尔·巴里·沙普利斯和丹麦科学家莫滕·梅尔达尔,以表彰他们在发展点击化学和生物正交化学方面的贡献。点击化学的代表反应为Cu催化的叠氮一炔基Husigen环加成反应,NaN₃、SO₂F₂、FSO₂N₂等均是点击化学中常用的无机试剂。回答下列问题:(1)、氮原子激发态的电子排布式有 , 其中能量最高的是(填标号)。
a.1s²2s²2p²3p¹ b.1s²2s²2p4 c.1s²2s²2p²3s¹ d.1s²2s²2p³
(2)、N、O、F的第一电离能最小的是 , SO₂F₂分子结构如图1所示,已知键角α为124°,β为96°,则α>β的原因主要是。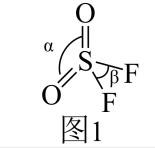 (3)、叠氮化物能与Fe³⁺、Cu²⁺及Co³⁺等形成配合物,如:[Co(N₃)(NH₃)₅]SO₄,该配合物中Co³⁺的配位数为。HN3分子的空间结构如图2所示(图中键长单位为10⁻10m)。
(3)、叠氮化物能与Fe³⁺、Cu²⁺及Co³⁺等形成配合物,如:[Co(N₃)(NH₃)₅]SO₄,该配合物中Co³⁺的配位数为。HN3分子的空间结构如图2所示(图中键长单位为10⁻10m)。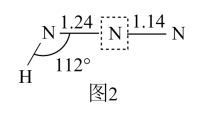
已知:①典型N-N、N=N和N≡N的键长分别为1.40×10⁻10m、1.20×10⁻10m和1.09×10⁻10m;②甲酸根的两个碳氧键键长相同,处于典型碳氧单键键长和碳氧双键键长之间,其结构可以用两个极端电子式(
 )的平均杂化体来表示。试画出HN3分子的两个极端电子式;“
)的平均杂化体来表示。试画出HN3分子的两个极端电子式;“ ”中N原子的杂化方式为。(4)、图3是MgCu₂的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。距离Mg原子最近的Mg原子有个。
”中N原子的杂化方式为。(4)、图3是MgCu₂的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。距离Mg原子最近的Mg原子有个。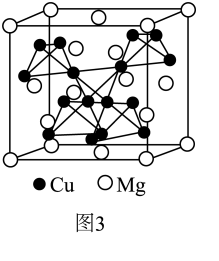 (5)、图4是沿立方格子对角面取得的截面,Mg原子的半径为pm,该晶胞的空间利用率为。
(5)、图4是沿立方格子对角面取得的截面,Mg原子的半径为pm,该晶胞的空间利用率为。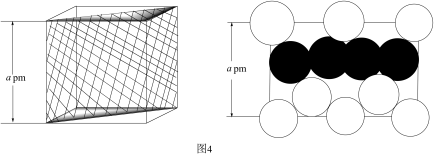
-
12. 治疗高血压的药物替利洛尔的一种合成路线如下。

已知:①RCOOHRCOClRCONHR'
②

③RCOONa+NaOHRH+Na2CO3
回答下列问题:
(1)、B分子中的含氧官能团的名称为。(2)、由B制备D的反应类型为反应,试剂a是。(3)、F分子的核磁共振氢谱中有两个波峰,则F的结构简式为 , G的化学名称为。(4)、K与L反应的化学方程式为。(5)、Q反应生成R的过程中,可能生成一种与R互为同分异构体的副产物,该副产物的结构简式为。(6)、写出由M制备P时中间产物1、3的结构简式(中间产物1、2互为同分异构体,部分试剂及反应条件已省略)。中间产物1、中间产物3
