河南省普通高中2023届高三高考适应性考试理综化学试题
试卷更新日期:2023-03-31 类型:高考模拟
一、单选题
-
1. 材料的发展推动着人类文明的进步。下列叙述错误的是A、自古以来我国的陶瓷制品享誉海内外,陶瓷属于无机非金属材料 B、三星堆遗址出土的青铜兽首冠人像使用的青铜属于合金 C、碳纤维被誉为“新材料之王”,是一种新型有机高分子材料 D、制造特种防护服的芳纶纤维属于合成高分子材料2. 下列反应的离子方程式正确的是A、向FeI2溶液中通入少量Cl2:2Fe2++Cl2=Fe3++2Cl- B、室温下,用稀硝酸溶解铜:3Cu+2NO+8H+=3Cu2++2NO↑+4H2O C、向0.1mol·L-1MgCl2溶液中加入足量石灰乳:Mg2++2OH-=Mg(OH)2↓ D、同体积同浓度的NH4HSO4溶液与NaOH溶液混合:+OH-=NH3·H2O3. 3体积浓硝酸和1体积浓盐酸组成的混合液叫做反王水,腐蚀能力强于王水,含有一种氧化性很强的离子(如图所示),其中不含氢元素。下列叙述错误的是( )
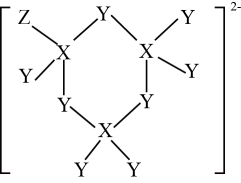 A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物4. 根据实验目的,下列实验操作及现象、实验结论都正确的是
A、原子半径:r(Z)>r(X)>r( Y) B、X、Z均能与Y形成多种化合物 C、该离子中各元素原子均满足8电子稳定结构 D、X、Y、Z的气态氢化物中,沸点最高的是X的气态氢化物4. 根据实验目的,下列实验操作及现象、实验结论都正确的是选项
实验目的
实验操作及现象
实验结论
A
检验硫酸厂周边空气是否含有SO2
用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,溶液不变色
空气中不含SO2
B
证明CH3COOH是弱电解质
用pH计分别测量醋酸溶液和盐酸的pH,醋酸溶液的pH大
CH3COOH是弱电解质
C
探究淀粉的水解程度
向淀粉水解液中加入NaOH溶液调节溶液至碱性,并分成两份,向第一份中加入银氨溶液并水浴加热出现银镜;向第二份中滴加少量碘水,溶液变蓝色
淀粉部分水解
D
探究卤素单质Cl2、Br2和I2的氧化性强弱
向NaBr溶液中通入过量氯气,溶液变橙色,再滴加淀粉KI溶液,溶液变蓝色
氧化性:Cl2>Br2>I2
A、A B、B C、C D、D5. 葫芦脲是超分子领域近年来发展迅速的大环主体分子之一,具有疏水的刚性空腔。葫芦[6]脲的结构简式如图所示,对位取代的苯的衍生物恰好可以进入葫芦[6]脲的空腔,下列关于葫芦[6]脲的说法正确的是
已知:
 A、属于高分子化合物 B、能发生水解反应 C、仅由乙二醛和尿素两种物质合成 D、邻甲基苯甲酸或间甲基苯甲酸易进入葫芦[6]脲的空腔6. Li-CO2电池在可逆的CO2循环和储能领域都具有巨大的潜力。研究发现,用不同材料作Li极催化剂时,CO2的放电产物不同,催化剂的使用情况和放电时的装置如下列图表所示,下列说法正确的是
A、属于高分子化合物 B、能发生水解反应 C、仅由乙二醛和尿素两种物质合成 D、邻甲基苯甲酸或间甲基苯甲酸易进入葫芦[6]脲的空腔6. Li-CO2电池在可逆的CO2循环和储能领域都具有巨大的潜力。研究发现,用不同材料作Li极催化剂时,CO2的放电产物不同,催化剂的使用情况和放电时的装置如下列图表所示,下列说法正确的是
Li极催化剂
碳化钼(Mo2C)
Au和多孔碳
CO2的放电产物
草酸锂(Li2C2O4)
Li2CO3和C
A、充电时,在a极上Li+被还原为Li B、放电时,Li+向b极移动 C、放电时,用碳化钼作Li极催化剂的总反应为2Li+2CO2=Li2C2O4 D、生成等物质的量的Li2C2O4和Li2CO3时,消耗CO2的量相同7. 已知SrF2属于微溶于水、可溶于酸的强碱弱酸盐。常温下,用HCl调节SrF2浊液的pH,测得在不同pH条件下,体系中—lgc(X)(X为Sr2+或F-)与lg的关系如图所示,下列说法正确的是 A、a点溶液中存在:2c(Sr2+)+c(H+)=c(F-)+c(OH-) B、c点溶液中存在:c(H+)=c(Cl-)+c(OH-)-c(F-) C、常温下,Ksp(SrF2)= D、常温下,氢氟酸的Ka数量级为
A、a点溶液中存在:2c(Sr2+)+c(H+)=c(F-)+c(OH-) B、c点溶液中存在:c(H+)=c(Cl-)+c(OH-)-c(F-) C、常温下,Ksp(SrF2)= D、常温下,氢氟酸的Ka数量级为二、非选择题
-
8. 冶金工业的钒渣含有V2O3、Cr2O3、SiO2、Fe2O3、FeO等,一种利用钒渣提钒并进行钒、铬分离的工艺流程如图所示:

已知:Ksp(BaCO3)=5.1×10-9 , Ksp(BaCrO4)=1.2×10-10 , Ksp(CaCrO4)=2.3×10-2;“净化液”中溶质只含有NaVO3、Na2CrO4。
请回答下列问题:
(1)、在“氧化焙烧”中被氧化的元素是(填元素符号)。(2)、为提高“水浸”效率,可采取的措施有(答出两条)。(3)、H2SO4“酸浸”得到的副产品①是 , 它的一种用途是。(4)、“调pH=2”,最适宜使用的酸是。(5)、“沉铬”反应的离子方程式为 , “沉铬”反应的理论转化率为(保留3位有效数字)。(6)、由于母液①最终返回到工序循环使用,因此,即使“沉铬”转化率低于理论值也不会对铬的回收产生多大的影响。(7)、用NaHSO4“浸出”时发生反应的化学方程式为。9. 酚酞(H2A)难溶于水,易溶于酒精,是一种有机弱酸,是常用的酸碱指示剂和分析试剂。实验室制备酚酞可采用如下步骤(装置如图所示,部分仪器略去):
I.将邻苯二甲酸酐(C8H4O3)与苯酚(C6H5OH)在b中混合,在剧烈搅拌下,缓慢滴加约2mL浓硫酸,加热至150℃进行反应,待b内固体反应物全部熔融为澄清的液态混合物后,停止加热。
II.装置冷却后,量取40mL稀硫酸,在揽拌下加入b中,从溶液中析出粗品酚酞后,抽滤混合物。
III.将粗品酚酞置于烧杯中,加适量水溶解,在不断搅拌下滴加饱和碳酸钠溶液。
IV.继续加入足量碳酸钠溶液,并加入适量水,搅拌。
V.抽滤烧杯中的混合物,洗涤滤渣,合并洗涤液,得到酚酞盐(A2-)溶液。
VI.将溶液转移至大烧杯中,在搅拌下滴加浓盐酸,直到红色褪去,出现白色浑浊,抽滤,滤渣为不溶的杂质。
VII.将滤液转移至大烧杯中,在搅拌下继续滴加浓盐酸,最终析出白色晶体,抽滤、洗涤得纯净的酚酞。
请回答下列问题:
(1)、装置图中,仪器a、b的名称分别是、。(2)、水槽c中盛放的物质是____(填字母)。A、水 B、植物油 C、无水乙醇(3)、步骤I中反应时间不宜过长,原因是。(4)、步骤III中使用的饱和碳酸钠溶液不能换成饱和碳酸氢钠溶液,原因是。(5)、步骤IV的作用是。(6)、步骤V中的洗涤剂应选用。(7)、步骤VII中滴加浓盐酸直到 , 最终析出白色晶体。10. 氨是具有潜力的载氢代氢清洁燃料。研究掺氨丙烷混合燃料的燃烧对于实现碳达峰、碳中和的目标具有现实意义。一定条件下,氨、丙烷充分燃烧的反应如下:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH2=-2044kJ•mol-1
对于不同配比的燃料,定义过量空气系数为完全燃烧1kg燃料所实际供给的空气质量与所需的理论空气质量的比值。
请回答下列问题:
(1)、已知在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成焓(ΔH)。常温常压下,相关物质的生成焓如下表所示:物质
NH3(g)
H2O(g)
ΔH(kJ•mol-1)
-46
-242
则ΔH1=kJ•mol-1
(2)、在100kPa下,10mol混合燃料在=1的条件下完全燃烧,产物只有CO2(g)、H2O(g)、N2(g)。若混合燃料中氨的体积分数为20%,则反应后混合气体中=kPa(保留3位有效数字);若10mol混合燃料中氨的体积分数为10%,计算同样条件下燃烧后释放的热量将增加kJ。(忽略温度变化对焓变的影响,假设空气中O2的体积分数为20%)(3)、研究表明,氨和丙烷混合燃烧排放的引起大气污染的气体主要是CO和NO。相关反应如下:I.4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH3<0,K1=8.5×1023(2065K)
II.4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH4<0,K2=7.0×1046(2065K)
III.N2(g)+O2(g)=2NO(g) ΔH5>0,ΔS>0
①反应III能自发进行的条件是。
②α分别为0.9、1.0、1.1时,烟气中CO排放浓度随氨体积分数变化的关系如图甲所示。α=0.9对应的曲线是(填“X”“Y”或“Z”),理由是。
③烟气中NO排放浓度随着氨的体积分数变化的关系如图乙所示。氨的体积分数大于10%时,NO排放浓度逐渐减低的原因为。

④丙烷中掺氨燃烧的优点是。
11. 中国古代艺术作品色彩艳丽,璀璨夺目,离不开矿物颜料的使用。请回答下列问题:(1)、雄黄(As4S4)和雌黄(As2S3)是矿物质颜料中的主要黄色颜料,它们是共生矿物,二者的分子均为非极性分子,结构分别如图所示。
①基态As原子的核外电子排布式为[Ar]。
②雌黄中As—S—As键角(填“大于”“小于”或“等于”)S—As—S键角。
③雄黄和雌黄比砷的氧化物的毒性要小很多,除结构稳定性的原因之外,从物理性质的角度分析,还与其有关。
(2)、我国古代很早就把青金石作为彩绘用的蓝色颜料,青金石是方钠石类铝硅酸盐中的一种,其化学式为(Na,Ca)8[AlSiO4]6[SO4 , S,Cl]2。①青金石的结构中、S2-代替了方钠石中部分Cl—的占位,Ca2+代替了部分Na+的占位,则方钠石的化学式为。
②青金石中第三周期各元素的第一电离能由大到小的顺序为。
③青金石的颜色与骨架内填入的阴离子有关,其中一种重要阴离子是三硫自由基阴离子。研究表明,三硫自由基阴离子(II)可以通过多硫阴离子S(I)在高温下的均裂反应得到,并最终可能异构化为另一种S的异构体(III),过程如下图:

关于I、II、III三种物质,下列说法正确的有(填字母)。
A.I中的S—S键都是σ键
B.II中的S原子最外层都满足8电子稳定结构
C.II的中心硫原子的杂化轨道类型为sp
D.与II互为等电子体
E.III一定为平面形结构
(3)、方解石在距今约7000年的仰韶文化时已开始作为白色颜料使用,是分布最广的矿物之一,其化学式为CaCO3。一定条件下,方解石的一种六方晶胞结构如图所示,晶胞底面为菱形,其较小夹角为60°,边长为anm,晶胞高为cnm。
①该方解石结构中阴离子的空间构型为。
②设NA为阿伏加德罗常数的值,则该方解石晶体的摩尔体积Vm=m3•mol-1(列出算式)。
12. Sharpless教授发现,在亚铜的催化下,末端炔烃可以高区域选择性地与叠氮化合物发生高效的Click(点击)反应,Sharpless教授也因此获得了2022年诺贝尔化学奖。科学家以乙烯和1,3-丁二烯( )等为原料,经过多步转化和Click反应合成化合物G,合成路线如下(Ph—表示苯基,部分反应条件已简化):
)等为原料,经过多步转化和Click反应合成化合物G,合成路线如下(Ph—表示苯基,部分反应条件已简化): 
Click反应示例:

请回答下列问题:
(1)、乙烯和1,3-丁二烯生成A的反应类型是。(2)、C的化学名称为。(3)、A→C的化学方程式为。(4)、D为环醚,其结构简式为。(5)、G的结构简式为。(6)、乙烯和1,3-丁二烯生成 的反应称为Diels-Alder反应,是有机化学合成反应中碳碳键形成的重要手段之一。两分子环戊二烯(
的反应称为Diels-Alder反应,是有机化学合成反应中碳碳键形成的重要手段之一。两分子环戊二烯( )也可以发生Diels-Alder反应生成二聚环戊二烯(分子式为C10H12),二聚环戊二烯的结构简式为。 (7)、在B的同分异构体中,同时满足下列条件的有种(不考虑立体异构)。
)也可以发生Diels-Alder反应生成二聚环戊二烯(分子式为C10H12),二聚环戊二烯的结构简式为。 (7)、在B的同分异构体中,同时满足下列条件的有种(不考虑立体异构)。a.最少有三个碳原子在一条直线上;
b.不含环状结构;
c.含有硝基和溴原子。
上述同分异构体中,在同一直线上的碳原子最多且含有手性碳(碳原子上连有4个不同的原子或基团时,该碳称为手性碳)的化合物的结构简式为。