河北省2023届高三下学期高考前适应性考试化学试题
试卷更新日期:2023-03-31 类型:高考模拟
一、单选题
-
1. 化学与科技、生产生活等各方面息息相关,下列说法错误的是A、Ge的单晶可以作为光电转换材料用于太阳能电池 B、2022冬奥部分场馆建筑应用了新材料碲化镉发电玻璃,其中碲和镉均属于过渡元素 C、牙膏中添加的SrF2、NaF提供的氟离子浓度相等时,它们防治龋齿的作用相当 D、冬天前用石灰浆喷洒树皮可以杀死虫卵2. 含主族元素N、F、Cl、As、Se等的某些化合物对工农业生产意义重大,下列说法正确的是A、N元素基态原子所有价电子的电子云轮廓图均为哑铃形 B、Se元素基态原子的电子排布式为[Ar]4s24p4 C、O、F、Cl电负性由大到小的顺序为F>Cl>O D、第一电离能As>Se3. 尼泊金甲酯(M,对羟基苯甲酸甲酯)是化妆品中的一种防腐剂,工业上用甲苯生产尼泊金甲酯的合成路线如图所示,下列说法正确的是
 A、反应①的条件为光照 B、1molM最多能与1molNaOH溶液反应 C、反应④的反应类型为取代反应 D、设计③和⑥这两步反应的目的是防止酚羟基被氧化4. 下列物质除杂方法错误的是A、除去Fe3+溶液中的少量Al3+:用过量的氨水除去 B、除去CO2中混有的H2S:通入CuSO4溶液除去 C、除去CuCl2溶液中混有的少量FeCl3:向混合溶液中加入足量CuO D、除去NO中的NO2:将混合气体通入水中5. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1molAlCl3晶体中含有的数目为3NA B、1mol熔融的KHSO4中含有离子总数为3NA C、常温常压下,2.2g由CO2和N2O组成的混合气体中含有的原子总数为0.15NA D、1mol[Co(NH3)5Cl]Cl2含有σ键的数目为15NA6. 下列装置或操作能达到实验目的的是
A、反应①的条件为光照 B、1molM最多能与1molNaOH溶液反应 C、反应④的反应类型为取代反应 D、设计③和⑥这两步反应的目的是防止酚羟基被氧化4. 下列物质除杂方法错误的是A、除去Fe3+溶液中的少量Al3+:用过量的氨水除去 B、除去CO2中混有的H2S:通入CuSO4溶液除去 C、除去CuCl2溶液中混有的少量FeCl3:向混合溶液中加入足量CuO D、除去NO中的NO2:将混合气体通入水中5. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1molAlCl3晶体中含有的数目为3NA B、1mol熔融的KHSO4中含有离子总数为3NA C、常温常压下,2.2g由CO2和N2O组成的混合气体中含有的原子总数为0.15NA D、1mol[Co(NH3)5Cl]Cl2含有σ键的数目为15NA6. 下列装置或操作能达到实验目的的是



A.检验乙炔的还原性
B.加热金属钠,观察钠燃烧现象
C.配制银氨溶液
D.探究浓度对化学反应速率的影响
A、A B、B C、C D、D7. 下列离子方程式书写正确的是A、将1molCl2通入含1molFeI2的溶液中:2Fe2++Cl2=2Fe3++2Cl- B、海水提溴工艺中,用纯碱溶液富集Br2:3Br2+3CO=5Br-+BrO+3CO2↑ C、向NaClO溶液中通入少量SO2:ClO-+SO2+H2O=SO+Cl-+2H+ D、自来水长期煮沸时生成水垢:xCa2++yMg2++(2x+y)HCOxCaCO3↓+yMgCO3↓+(x+y)CO2↑+(x+y)H2O8. 工业上用发烟HClO4将潮湿的CrCl3氧化为棕色的烟[CrO2(ClO4)2],来除去Cr(Ⅲ),离子方程式为ClO+Cr3++→CrO2(ClO4)2+Cl-+。下列说法正确的是A、HClO4属于弱酸 B、CrO2(ClO4)2为还原产物 C、该反应中,参加反应的氧化剂与还原剂的物质的量之比为19∶8 D、反应过程中溶液的pH减小9. 一种脱除和利用水煤气中CO2方法的如图,下列说法中错误的是 A、b为电源的正极 B、利用电化学原理,将CO2电催化为C2H4的反应式为2CO2-12e-+12H+=C2H4+4H2O C、再生塔中产生CO2的离子方程式为2H2O+CO2↑+ D、某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后,c():c()=1:2,则该溶液的pH=10(该温度下H2CO3的Ka1=4.6×10-7;Ka2=5.0×10-11)10. (CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+ , 下列说法正确的是
A、b为电源的正极 B、利用电化学原理,将CO2电催化为C2H4的反应式为2CO2-12e-+12H+=C2H4+4H2O C、再生塔中产生CO2的离子方程式为2H2O+CO2↑+ D、某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后,c():c()=1:2,则该溶液的pH=10(该温度下H2CO3的Ka1=4.6×10-7;Ka2=5.0×10-11)10. (CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+ , 下列说法正确的是 A、Pb2+的价电子排布式为:6s26p2 B、A代表I- C、若原子分数坐标A为(0,0,0),B为( , , ),则C的原子分数坐标为(0, , ) D、已知CH3NH3)PbI3的摩尔质量为Mg·mol-1 , NA为阿伏加德罗常数的值,则该晶体的密度为g•cm-311. X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11,其中Y元素最高与最低化合价的代数和为2,Y和Z的单质生成的化合物是一种传递神经信息的“信使分子”,R的原子半径是五种元素中最大的,Y和W是同族元素。下列说法正确的是A、简单离子的半径:W>Y>Z B、简单氢化物的稳定性:Y<W C、若R为非金属,R的最高价氧化物是酸性氧化物,不能与任何酸反应 D、标准状况下,1molYZ与0.5molZ2混合后所得气体的体积为22.4L12. 钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为VO2∙xH2O、Cr(OH)3及少量的SiO2。一种初步分离钒铬还原渣中钒铬并获得Na2Cr2O7的工艺流程如图。
A、Pb2+的价电子排布式为:6s26p2 B、A代表I- C、若原子分数坐标A为(0,0,0),B为( , , ),则C的原子分数坐标为(0, , ) D、已知CH3NH3)PbI3的摩尔质量为Mg·mol-1 , NA为阿伏加德罗常数的值,则该晶体的密度为g•cm-311. X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11,其中Y元素最高与最低化合价的代数和为2,Y和Z的单质生成的化合物是一种传递神经信息的“信使分子”,R的原子半径是五种元素中最大的,Y和W是同族元素。下列说法正确的是A、简单离子的半径:W>Y>Z B、简单氢化物的稳定性:Y<W C、若R为非金属,R的最高价氧化物是酸性氧化物,不能与任何酸反应 D、标准状况下,1molYZ与0.5molZ2混合后所得气体的体积为22.4L12. 钒铬还原渣是钠化提钒过程的固体废弃物,其主要成分为VO2∙xH2O、Cr(OH)3及少量的SiO2。一种初步分离钒铬还原渣中钒铬并获得Na2Cr2O7的工艺流程如图。
已知:①“酸浸”后为VO2∙xH2O转化为VO2+;
②Cr(OH)3的Ksp近似为1×10-31;下列说法正确的是
A、滤渣的成分为H2SiO3 B、“氧化”生成发生反应的离子方程式为2VO3+++2H2O=2+2+4H+ C、若“含Cr3+净化液”中c(Cr3+)=0.1mol/L,则“水解沉钒”调pH应不超过10 D、“溶液1”中含 , 加入H2O2后发生反应的离子方程式为2+3H2O2+2OH-=2+2H++2H2O13. 下列实验结论或解释错误的是选项
实验操作和现象
结论或解释
A
做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,洗涤效果更好
Fe3++AgFe2++Ag+ , 加入稀盐酸,Cl-与Ag+结合生成氯化银沉淀,使平衡右移
B
将200mL5mol•L-1的Na2CO3溶液加热到60℃,用pH传感器测定pH值,测得溶液的pH值逐渐减小
Kw改变与水解平衡移动共同作用的结果
C
用注射器多次抽取硫酸厂附近的空气样品慢慢注入盛有品红的同一试管中,品红不变色
空气样品中几乎不含SO2
D
取2mL0.5mol/L的CuCl2溶液于试管中,置于冷水中,溶液呈蓝色;一段时间后取出加热,溶液逐渐变黄
[Cu(H2O)4]2++4Cl-4H2O+[CuCl4]2-是放热反应
A、A B、B C、C D、D14. 草酸(H2C2O4)是一种常见的二元弱酸,0.010mol/L的H2C2O4溶液中H2C2O4、和的物质的量分数δ(X)随pH变化如图。下列说法正确的是 A、曲线①表示的物质的量分数δ(X)随pH变化关系 B、NaHC2O4溶液中c(OH-)>c(H+) C、0.01mol/LNaHC2O4溶液中,c()+c(OH-)=c(H+)+c(H2C2O4) D、反应H2C2O4+2的化学平衡常数为10-5.4
A、曲线①表示的物质的量分数δ(X)随pH变化关系 B、NaHC2O4溶液中c(OH-)>c(H+) C、0.01mol/LNaHC2O4溶液中,c()+c(OH-)=c(H+)+c(H2C2O4) D、反应H2C2O4+2的化学平衡常数为10-5.4二、非选择题
-
15. 氧钒(IV)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}是制备多种含钒产品和催化剂的基础原料和前驱体。利用纯净的VOCl2制备氧钒(IV)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的装置如图:

实验过程:将净化的VOCl2溶液缓慢加入到足量NH4HCO3溶液,有气泡产生,析出紫红色晶体。待反应结束后,在有CO2保护气的环境中,将混合液静置一段时间,抽滤,所得晶体,洗涤2次,得到粗产品。回答下面问题:
(1)、装置A中的仪器名称是 , 装置C中a玻璃导管的作用是。(2)、装置B中反应的离子方程式。(3)、实验开始先关闭K2 , (填实验现象),关闭K1、打开K2进行实验。(4)、写出装置C中发生反应的化学方程式。(5)、下列装置不能代替装置A的是。 (6)、抽滤装置如图所示:
(6)、抽滤装置如图所示:
仪器b的名称是 , 仪器c的作用是。
(7)、测定粗产品中钒的含量,称取2.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解,滴入几滴亚铁氰化钾K4[Fe(CN)6]溶液,用0.2mol/L的Fe2(SO4)3标准溶液进行滴定,滴定终点消耗标准溶液的体积为20.00mL。(假设杂质中不含钒,杂质也不参与反应,滴定反应为:VO2++Fe3++H2O=VO+Fe2++2H+。)①滴定终点时的现象为。
②粗产品中钒的质量分数为。
16. 金属钴(Co)是一种重要的战略金属,有着较为广泛的用途。如图是利用含钴废料(主要成分为Co2O3 , 还含少量Fe2O3、Al2O3、MgO、CaO、SiO2等杂质)制备草酸钴的工艺流程。回答下面问题: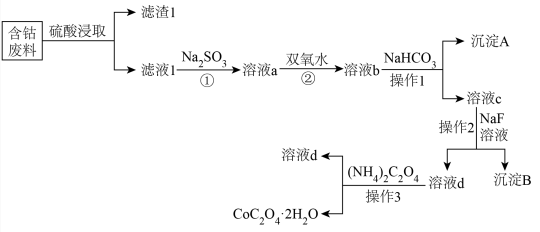 (1)、在“硫酸浸取”时,能提高“酸浸”速率的方法有(任写一种)。滤渣1的成分是(写化学式)。(2)、写出反应①的离子方程式:、。写出反应②的离子方程式:。(3)、操作1中加入NaHCO3的作用是。(4)、已知:Ksp(CaF2)=5.3×10-9 , Ksp(MgF2)=5.2×10-12 , 若向溶液c中加入NaF溶液,当Mg2+恰好沉淀完全,即溶液中c(Mg2+)=1.0×10-5mol•L-1 , 此时溶液中c(Ca2+)最大等于mol•L-1。(5)、若沉钴中得到二水合草酸钴CoC2O4·2H2O(M=183g/mol)热分解质量变化过程如图所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,请写出从反应B点到C点的化学方程式。
(1)、在“硫酸浸取”时,能提高“酸浸”速率的方法有(任写一种)。滤渣1的成分是(写化学式)。(2)、写出反应①的离子方程式:、。写出反应②的离子方程式:。(3)、操作1中加入NaHCO3的作用是。(4)、已知:Ksp(CaF2)=5.3×10-9 , Ksp(MgF2)=5.2×10-12 , 若向溶液c中加入NaF溶液,当Mg2+恰好沉淀完全,即溶液中c(Mg2+)=1.0×10-5mol•L-1 , 此时溶液中c(Ca2+)最大等于mol•L-1。(5)、若沉钴中得到二水合草酸钴CoC2O4·2H2O(M=183g/mol)热分解质量变化过程如图所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,请写出从反应B点到C点的化学方程式。 (6)、用乙醇燃料电池作电源电解含Co2+的水溶液制备金属钴,其装置如图甲、乙。
(6)、用乙醇燃料电池作电源电解含Co2+的水溶液制备金属钴,其装置如图甲、乙。
①图乙中Co电极应连接乙醇燃料电池的极(填“a”或“b”)。
②图甲中a极上发生的电极反应是。
17. 氮氧化物和一氧化碳污染指数是衡量空气质量的重要标准,它们的治理刻不容缓。回答下列问题:(1)、已知:①CO2(g)+C(s)2CO(g) △H1=+172.5kJ•mol-1②C(s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
③2NO(g)N2(g)+O2(g) △H3=-180.5kJ•mol-1
则CO还原NO的热化学方程式为 , 在此反应中为提高NO的平衡转化率同时提高反应速率,可以采取的措施是(答出一条即可)。
(2)、已知:2NO(g)N2(g)+O2(g) △H3=-180.5kJ•mol-1中v正=k正×c2(NO)、v逆=k逆×c(N2)×c(O2),(k正、k逆分别为正逆反应速率常数)。①该反应在某条件下达到平衡后,降低温度,k正(填“增大”或“减小”,下同),k正:k逆=。
②下列有关说法正确的是(填标号)。
A.延长反应时间有利于提高N2的平衡产率
B.适当增大NO(g)的浓度,有利于提高NO的平衡转化率
C.恒温、固定容积的密闭容器中,混合气体的压强保持不变时达到平衡
D.体系达平衡后,若压缩体积,平衡不发生移动,但是逆反应速率变快
(3)、一定条件下,CH4分解生成碳的反应历程如图所示。该历程分4步进行,其中第步为放热反应,正反应活化能最大一步的反应方程式为。 (4)、在实验室模拟工业合成甲醇的反应,CO(g)+2H2(g)CH3OH(g) △H<0。在一恒压密闭容器内充入1molCO、2molH2和1molHe(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如表:
(4)、在实验室模拟工业合成甲醇的反应,CO(g)+2H2(g)CH3OH(g) △H<0。在一恒压密闭容器内充入1molCO、2molH2和1molHe(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如表:反应时间/min
0
10
20
30
40
50
60
容器体积/L
4
3.5
3.2
3.0
2.9
2.8
2.8
则氢气的平衡转化率为 , 该温度下的平衡常数Kp为(MPa)-2(Kp为以分压表示的平衡常数,请用含p的式子表示)。
18. 化合物M是一种合成药物中间体,一种合成化合物M的人工合成路线如图:
已知:R1-NH2+R2-CHOR1-NH-CHOH-R2
回答下面问题:
(1)、有机物F中的含氧官能团的名称是。(2)、有机物A能发生银镜反应,核磁共振氢谱中有四组峰,峰面积之比为2∶2∶1∶1,写出有机物A的结构简式。(3)、有机物C生成有机物D的反应类型为。有机物E生成有机物F的反应条件是。(4)、写出有机物H的结构简式。(5)、写出有机物D生成有机物E的反应方程式。(6)、写出有机物H生成有机物M的反应方程式。(7)、满足下列条件的有机物C的同分异构体有种,苯环上有四种取代基,其中氯原子、羟基和氨基直接与苯环相连且两两互不相邻。(8)、写出 和2-丙醇(
和2-丙醇( )为原料制备
)为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。