山东省烟台市、德州市、滨州市2023届高三一模考试化学试题
试卷更新日期:2023-03-29 类型:高考模拟
一、单选题
-
1. 化学与科技、生活密切相关,下列说法错误的是A、印制货币票面文字、号码等处使用含Fe3O4的油墨,利用了Fe3O4的稳定性 B、“奋斗者”号万米深潜载人舱球壳所使用的钛合金属于金属材料 C、卡塔尔世界杯用球“旅程”使用水性涂料代替有机涂料,更加环保 D、“北斗三号”采用星载氢原子钟,通过电子跃迁产生电磁波进行精准定位2. 下列过程不涉及氧化还原反应的是A、自然固氮 B、纯碱除油污 C、海水提溴 D、电解精炼铜3. 下列实验装置的使用及操作正确的是
 A、①制备溴苯并验证有HBr产生 B、②制备并收集干燥的氨气 C、③制备NaHCO3 D、④钠的燃烧反应4. 小分子物质a通过选择性催化聚合可分别得到聚合物b、c.下列说法正确的是
A、①制备溴苯并验证有HBr产生 B、②制备并收集干燥的氨气 C、③制备NaHCO3 D、④钠的燃烧反应4. 小分子物质a通过选择性催化聚合可分别得到聚合物b、c.下列说法正确的是 A、a难溶于水 B、a分子中所有碳原子一定共平面 C、a与足量H2加成后的产物中含有两个手性碳原子 D、反应①和②均属于加聚反应5. 下列由实验操作、现象所得结论正确的是
A、a难溶于水 B、a分子中所有碳原子一定共平面 C、a与足量H2加成后的产物中含有两个手性碳原子 D、反应①和②均属于加聚反应5. 下列由实验操作、现象所得结论正确的是实验操作和现象
实验结论
A
将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去
铁锈中含有二价铁
B
用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变
CF2Cl2是极性分子
C
石蜡油加强热,将产生的气体通入溴水,溴水颜色褪去
气体中含有乙烯
D
用pH计分别测0.1molL-1NaClO和CH3COONa溶液的pH,前者pH大
Ka(HClO)>Ka(CH3COOH)
A、A B、B C、C D、D6. 短周期主族元素X、Y、Z原子序数依次增大,可与C、H形成结构如图的离子液体。已知阳离子中的环状结构与苯类似,下列说法错误的是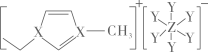 A、原子半径:Z>X>Y B、第一电离能:Y>X>Z C、阳离子中存在π大π键 D、X2Y2电子式:
A、原子半径:Z>X>Y B、第一电离能:Y>X>Z C、阳离子中存在π大π键 D、X2Y2电子式: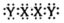 7. Cu2+可以与缩二脲(H2NCONHCONH2)形成紫色配离子,结构如图所示。下列说法正确的是
7. Cu2+可以与缩二脲(H2NCONHCONH2)形成紫色配离子,结构如图所示。下列说法正确的是 A、该配离子需在碱性条件下制备 B、该配离子中碳原子和氮原子都采取sp3杂化 C、该配离子中配位键强度:Cu—N<Cu—O D、1mol该配离子中含有的配位键数目为6NA8. 利用V2O3制备氧钒碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的工艺流程如下:
A、该配离子需在碱性条件下制备 B、该配离子中碳原子和氮原子都采取sp3杂化 C、该配离子中配位键强度:Cu—N<Cu—O D、1mol该配离子中含有的配位键数目为6NA8. 利用V2O3制备氧钒碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的工艺流程如下:
已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
A、V2O3制备NaVO3过程中,氧化剂与还原剂物质的量之比为1:2 B、生成V2O5的反应为2NaVO3+2NH4Cl2NaCl+V2O5+2NH3↑ C、由V2O5制备VOCl2的两种路径,路径I更符合绿色化学思想 D、路径II中若盐酸浓度过低,可能生成副产物VO2Cl9. 对乙酰氨基酚(a)具有解热镇痛作用,由对乙酰氨基酚可合成更为长效的对乙酰氨基酚缓释片(b)。下列说法错误的是 A、a的分子式为C8H9NO2 B、a能与溴水发生取代反应 C、1molb一定条件下与NaOH溶液反应,最多可消耗3molNaOH D、a苯环上的二溴代物有4种10. 在Fe2+催化作用下,C2H6与N2O制备乙醛的反应机理如图所示。下列说法正确的是
A、a的分子式为C8H9NO2 B、a能与溴水发生取代反应 C、1molb一定条件下与NaOH溶液反应,最多可消耗3molNaOH D、a苯环上的二溴代物有4种10. 在Fe2+催化作用下,C2H6与N2O制备乙醛的反应机理如图所示。下列说法正确的是 A、X为C2H5OH,是中间产物之一 B、过程①~⑥,Fe元素的化合价均发生了变化 C、增加Fe+的量,C2H6平衡转化率不变 D、每消耗1molN2O,可制备0.5molCH3CHO11. 某同学用如图所示装置进行实验,预测现象与实际不相符的是
A、X为C2H5OH,是中间产物之一 B、过程①~⑥,Fe元素的化合价均发生了变化 C、增加Fe+的量,C2H6平衡转化率不变 D、每消耗1molN2O,可制备0.5molCH3CHO11. 某同学用如图所示装置进行实验,预测现象与实际不相符的是
①中物质
②中物质
预期现象
A
乙醇
酸性KMnO4溶液
紫色溶液颜色变浅或退去
B
H2S溶液
Na2SO3溶液
溶液变浑浊、产生气泡
C
H2O2溶液
淀粉KI溶液
溶液变蓝
D
浓氨水
AlCl3溶液
生成白色沉淀后又溶解
A、A B、B C、C D、D12. 科研人员通过控制光沉积的方法构建复合材料光催化剂,以Fe2+和Fe3+渗透Nafion膜在酸性介质下构建了一个还原和氧化分离的人工光合体系,其反应机理如图。下列说法正确的是 A、a的价电子排布式:3d5 B、体系中能量转化形式:电能→化学能 C、体系中总反应的活化能:Ea正>Ea逆 D、理论上每消耗18g水生成46gHCOOH13. 电解苯酚的乙腈(CH3—CN)水溶液可在电极上直接合成扑热息痛(
A、a的价电子排布式:3d5 B、体系中能量转化形式:电能→化学能 C、体系中总反应的活化能:Ea正>Ea逆 D、理论上每消耗18g水生成46gHCOOH13. 电解苯酚的乙腈(CH3—CN)水溶液可在电极上直接合成扑热息痛( ),装置如图,其中电极材料均为石墨。下列说法错误的是
),装置如图,其中电极材料均为石墨。下列说法错误的是 A、电极a为负极 B、装置工作时,乙室溶液pH减小 C、c的电极反应式为
A、电极a为负极 B、装置工作时,乙室溶液pH减小 C、c的电极反应式为 +CH3-CN+H2O-2e-
+CH3-CN+H2O-2e- +2H+
D、合成1mol扑热息痛,理论上甲室质量增重64g
14. 废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb及少量BaSO4 , 从中回收PbO的工业流程及一些难溶电解质的溶度积常数如下:
+2H+
D、合成1mol扑热息痛,理论上甲室质量增重64g
14. 废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb及少量BaSO4 , 从中回收PbO的工业流程及一些难溶电解质的溶度积常数如下:
难溶电解质
PbSO4
PbCO3
BaSO4
BaCO3
Ksp
2.5×10-8
7.4×10-14
1.1×10-10
2.6×10-9
下列说法错误的是
A、“脱硫”的目的是将PbSO4转化为PbCO3 B、滤渣的主要成分为BaSO4 C、“酸浸”时加入的H2O2既可做氧化剂又可做还原剂 D、“沉铅”后的滤液中存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)15. 分析化学中“滴定分数”的定义为滴定过程中标准溶液与待测溶液溶质的物质的量之比。常温下用0.01mol·L-1的NaOH溶液滴定0.01mol·L-1某二元弱酸H2R溶液的滴定曲线如图所示。下列说法错误的是 A、H2R的Ka1约为5.67×10-2 , Ka2约为4×10-5 B、从b点到e点,溶液中一定存在:c(R2-)>c(H2R) C、c点溶液中,c(R2-)+c(OH-)=c(HR-)+c(H+)+3c(H2R) D、滴定过程中,混合溶液中始终增大
A、H2R的Ka1约为5.67×10-2 , Ka2约为4×10-5 B、从b点到e点,溶液中一定存在:c(R2-)>c(H2R) C、c点溶液中,c(R2-)+c(OH-)=c(HR-)+c(H+)+3c(H2R) D、滴定过程中,混合溶液中始终增大二、非选择题
-
16. 铜及其化合物在机械制造、国防建设中有着广泛的应用。回答下列问题:(1)、铜元素在元素周期表中的位置是。(2)、Cu2+能与NH3形成具有对称空间结构的[Cu(NH3)4]2+。
①[Cu(NH3)4]2+的H—N—H键角(填“>”、“=”或“<”)NH3的H-N-H键角。
②若[Cu(NH3)4]2+中两个NH3分别被Cl-取代,能得到(m)、(n)两种不同结构的Cu(NH3)2Cl2:

[Cu(NH3)4]2+的空间构型是;在水中的溶解度:(m)(n)(填“>”、“=”或“<”)。
③NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,理由是。
(3)、一种钇钡铜氧晶体属四方晶系,品胞参数如图所示,晶胞棱长夹角均为90°。晶体中Y元素的化合价为+3价,Cu元素以+2和+3两种价态存在。基态Cu3+的价层电子的轨道表示式为;设NA为阿伏加德罗常数的值,钇钡铜氧的摩尔质量为Mg·mol-1 , 则该晶体的密度为g·cm-3(列出计算式);晶体中Cu3+与Cu2+个数比为。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。如原子分数坐标A为(0,0,0),B为( , , ),C为( , , m),则D的原子分数坐标为。 17. 工业上以制备抗癌药物“顺铂”[Pt(NH3)2Cl2]的废渣——含铂的碘化银为主要原料回收银粉和海绵铂的工艺流程如下:
17. 工业上以制备抗癌药物“顺铂”[Pt(NH3)2Cl2]的废渣——含铂的碘化银为主要原料回收银粉和海绵铂的工艺流程如下:
已知:①N2H4是一种强还原剂,在碱性条件下可将多数金属离子还原成单质。
②Ksp(AgCl)=1.8×10-10 , NaCl在浓硫酸中难溶,Ag2SO4在不同浓度硫酸中的溶解量如下:
硫酸浓度/(mol•L-1)
18
15
12
9
6
0
硫酸银溶解量/(g•L-1)
209.00
78.94
31.20
11.14
8.74
4.68
回答下列问题:
(1)、“顺铂”分子中Pt的化合价为。(2)、“氧化浸出”中,应选用上表所列mol·L-1H2SO4 , 发生反应的化学方程式为。(3)、“稀释”在陶瓷反应釜中进行,具体操作为;“沉银”过程中反应Ag2SO4(s)+2Cl-(aq)⇌2AgCl(s)+(aq)的化学平衡常数为mol-1·L。(4)、“还原浸出”制银粉过程中有N2产生,发生反应的离子反应方程式为;该工艺经物理处理,可再生循环利用的物质有(填化学式)。18. 实验室通过固体碱熔氧化法制备KMnO4.具体实验过程如下:(1)、I.制备K2MnO4溶液将KClO3和KOH置于铁坩埚中加热熔融,分多次将MnO2粉末加入,强热5分钟。充分反应后冷却,将固体捣碎,加水溶解,微热,趁热减压过滤得到K2MnO4溶液。
反应的化学方程式为。
(2)、选用铁坩埚不用瓷坩埚的原因是。(3)、II.K2MnO4的歧化制备KMnO4实验原理:3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3
实验装置如图所示,将K2MnO4溶液转移到三颈烧瓶中,关闭旋塞2、5,打开旋塞1、3、4,趁热往K2MnO4溶液中通入CO2发生反应,没有反应的CO2被收集到气囊a中。

待气囊a收集到较多气体时,关闭旋塞1和旋塞 , 打开旋塞 , 轻轻挤压气囊a,将气体压入K2MnO4溶液中继续反应。未反应的CO2又被收集在气囊b中,如此反复直至K2MnO4完全歧化,经过一系列操作得到KMnO4晶体。整个过程中温度不宜过高的原因是。
(4)、III.KMnO4的纯度分析准确称取2.00gKMnO4产品溶于水,配成100.00mL溶液。用移液管取25.00mL0.2mol·L-1的H2C2O4溶液于锥形瓶中,并加入2mL稀硫酸。用上述KMnO4溶液滴定H2C2O4溶液,重复操作3次,消耗KMnO4溶液的体积平均为20.00mL。
滴定终点的现象是 , 计算可得产品中KMnO4的纯度是 , 下列情况会导致KMnO4纯度测定值偏小的是(填标号)。
A.产品含少量K2MnO4 B.酸式滴定管滴定后有气泡
C.酸式滴定管没有润洗 D.滴定接近终点时用少量蒸馏水冲洗锥形瓶内壁
19. 氯霉素(H)的一种合成路线如下:
已知:

回答下列问题:
(1)、A的名称为;A→B反应类型为。(2)、C→D的化学方程式为;符合下列条件的E的同分异构体有种。①含有酚羟基和氨基 ②苯环上有两个取代基 ③能发生水解反应
(3)、F的结构简式为;试剂a为;G中含氧官能团有种。(4)、根据上述信息,写出以乙烯为主要原料制备 的合成路线。 20. 甲烷在化学工业中应用广泛。回答下列问题:(1)、H2捕集CO2合成CH4涉及下列反应:
的合成路线。 20. 甲烷在化学工业中应用广泛。回答下列问题:(1)、H2捕集CO2合成CH4涉及下列反应:I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=kJ·mol-1 , 升高温度,(填“增大”或“减小”)。

②起始物=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=Pa,反应I以物质的量分数表示的平衡常数KxI=。
 (2)、CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
(2)、CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将(填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)(填“增大”、“减小”或“不变”),p(CO)(填“增大”、“减小”或“不变”)。