山东省青岛市2023届高三下学期一模化学试题
试卷更新日期:2023-03-29 类型:高考模拟
一、单选题
-
1. 2022年中国十大科技新闻之一是物理化学科学家联合突破海水无淡化原位直接电解制氢技术,向大海要水要资源又有新进展。下列说法正确的是A、该过程将化学能转化为电能 B、、、互为同位素 C、氢能源代替化石能源可缓解海水酸化 D、实验室电解水常加入少量稀盐酸增强导电性
-
2. 叠氮化铅用作水下引爆剂,可由以下方法制得
I:;
Ⅱ:。下列说法正确的是
A、的键角大于的键角 B、为非极性分子 C、反应I中氧化剂和还原剂的物质的量之比可能为 D、反应I每消耗钠,共转移电子 -
3. 软包电池的关键组件结构如图所示。X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,X元素最外层电子数是次外层电子数的一半,W和Q同主族。下列说法错误的是
 A、简单离子半径 B、简单气态氢化物的热稳定性 C、常温下M单质可以置换出W单质 D、为V形分子,其沸点高于W
A、简单离子半径 B、简单气态氢化物的热稳定性 C、常温下M单质可以置换出W单质 D、为V形分子,其沸点高于W -
4. 黑磷具有与石墨相似的层状结构,其结构如图所示。下列分析错误的是
 A、黑磷中既存在非极性共价键又存在范德华力 B、黑磷的熔点高于白磷 C、黑磷中P原子杂化方式为 D、第三周期只有元素的第一电离能大于P
A、黑磷中既存在非极性共价键又存在范德华力 B、黑磷的熔点高于白磷 C、黑磷中P原子杂化方式为 D、第三周期只有元素的第一电离能大于P -
5. 氧化法制备联苯衍生物的转化过程如图所示。下列说法错误的是
 A、②③发生消去反应 B、②③中最多处于同一平面的碳原子数相同 C、⑤的苯环上的一氯代物有6种 D、④与浓溴水反应最多可消耗
A、②③发生消去反应 B、②③中最多处于同一平面的碳原子数相同 C、⑤的苯环上的一氯代物有6种 D、④与浓溴水反应最多可消耗 -
6. 下列实验操作规范的是
 A、①灼烧干海带 B、②检验铜与浓硫酸反应的氧化产物 C、③用萃取碘水中的碘,振荡、放气 D、④配制溶液定容后摇匀
A、①灼烧干海带 B、②检验铜与浓硫酸反应的氧化产物 C、③用萃取碘水中的碘,振荡、放气 D、④配制溶液定容后摇匀 -
7. 根据实验目的,下列实验及现象、结论都正确的是
选项
实验目的
实验现象
结论
A
探究有机物中官能团之间的影响
分别向丙烯酸乙酯和氰基丙烯酸乙酯中滴入水,前者无明显现象,后者快速固化
氰基活化双键,使其更易发生加聚反应
B
比较、和的氧化性
向酸性溶液中滴入溶液,紫红色溶液变浅并伴有黄绿色气体产生
氧化性:
C
纤维素水解实验
将脱脂棉放入试管中,滴入硫酸捣成糊状,后用溶液调至碱性,加入新制悬浊液,无砖红色沉淀产生
纤维素未发生水解
D
探究不同价态硫元素之间的转化
向和混合溶液中加入浓硫酸,溶液中出现淡黄色沉淀
价和价硫可归中为0价
A、A B、B C、C D、D -
8. 吲哚布芬是抗血栓药物,结构如图所示。关于该有机物说法错误的是
 A、分子式为 B、存在对映异构体 C、吲哚布芬最多能与反应 D、不能使酸性溶液褪色
A、分子式为 B、存在对映异构体 C、吲哚布芬最多能与反应 D、不能使酸性溶液褪色 -
9. 溴苯可用于生产镇痛解热药和止咳药,其制备、纯化流程如图。下列说法错误的是
 A、“过滤”可除去未反应的铁粉 B、“除杂”使用饱和NaHSO3溶液可除去剩余的溴单质 C、“干燥”时可使用浓硫酸作为干燥剂 D、“蒸馏”的目的是分离苯和溴苯
A、“过滤”可除去未反应的铁粉 B、“除杂”使用饱和NaHSO3溶液可除去剩余的溴单质 C、“干燥”时可使用浓硫酸作为干燥剂 D、“蒸馏”的目的是分离苯和溴苯 -
10. 某溴丁烷与乙醇反应的能量转化如图( “
 ”表示过渡态)。下列说法错误的是
”表示过渡态)。下列说法错误的是
 A、总反应为取代反应 B、该反应过程中C原子杂化方式有变化 C、加可以加快该反应的反应速率 D、该过程正逆反应的决速步骤不同
A、总反应为取代反应 B、该反应过程中C原子杂化方式有变化 C、加可以加快该反应的反应速率 D、该过程正逆反应的决速步骤不同 -
11. 纯磷酸(易吸潮,沸点)可由的磷酸减压蒸馏除水、结晶得到。实验装置如图。该过程需严格控制温度,高于时会脱水生成焦磷酸。下列说法正确的是
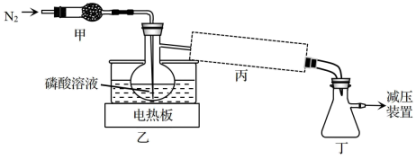 A、由毛细管通入可防止暴沸,并具有搅拌和加速水逸出的作用 B、丙处应连接球形冷凝管 C、磷酸易吸潮是因为它可与水形成氢键 D、连接减压装置的目的是降低磷酸沸点
A、由毛细管通入可防止暴沸,并具有搅拌和加速水逸出的作用 B、丙处应连接球形冷凝管 C、磷酸易吸潮是因为它可与水形成氢键 D、连接减压装置的目的是降低磷酸沸点 -
12. 我国首创高钛渣沸腾氯化法获取 , 以高钛渣(主要成分为 , 含少量V、和的氧化物杂质)为原料采用该方法获取并制备金属钛的流程如下。下列说法错误的是

流程中几种物质的沸点如表
物质
沸点
136
127
57
180
A、“除钒”反应为 B、“除硅、铝”过程中,可通过蒸馏的方法分离中含、的杂质 C、“除钒”和除“硅、铝”的顺序可以交换 D、“反应器”中应增大湿度以提高反应速率 -
13. 八钼酸铵可用于染料、催化剂、防火剂等。该化合物可通过电渗析法获得,工作原理如图。下列说法错误的是
 A、a连接电源正极 B、生成的反应为 C、电解一段时间后,b极附近氨水的浓度减小 D、双极膜附近的移向左侧
A、a连接电源正极 B、生成的反应为 C、电解一段时间后,b极附近氨水的浓度减小 D、双极膜附近的移向左侧 -
14. 联氨的性质类似于氨气,将联氨加入悬浊液转化关系如图。下列说法错误的是
 A、的沸点高于 B、通入氧气反应后,溶液的将减小 C、当有参与反应时消耗 D、加入的反应为
A、的沸点高于 B、通入氧气反应后,溶液的将减小 C、当有参与反应时消耗 D、加入的反应为 -
15. 时,向的溶液()中通入或加入调节 , 不考虑溶液体积变化且过程中无气体逸出。含碳(或氮)微粒的分布分数[如:]与关系如图。下列说法正确的是
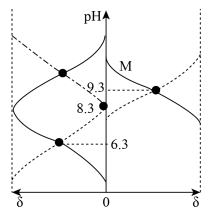 A、溶液中存在: B、曲线M表示的分布分数随变化 C、的 D、该体系中
A、溶液中存在: B、曲线M表示的分布分数随变化 C、的 D、该体系中
二、非选择题
-
16. 研究金属原子结构及晶体结构具有重大意义。(1)、价电子轨道表示式为。(2)、原子发射光谱法是通过处于激发态的待测元素微粒回到基态时发射的特征谱线对其进行鉴别的方法。下列状态的铁粒子处于激发态的是____(填标号)。A、 B、 C、 D、(3)、利用配合物的特征颜色可检验补铁药片中的和 , 部分配合物的结构如下:

①取等量碾碎的药片放入两支试管中,试管1加盐酸溶解,试管2加等体积蒸馏水溶解。分别滴加溶液,发现试管1溶液变红,试管2溶液不变色。依据图示信息,解释检验须在酸性条件下进行的原因。
②配体SCN的空间构型为。
③邻二氮菲中N原子的价层孤电子对占据。(填标号)。
A.轨道 B.轨道 C.杂化轨道 D.杂化轨道
(4)、金属合金的结构可看作以四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置原子(四面体的4个顶点代表原子,圆球代表原子),结构如图所示。
①。
②若原子A的原子坐标为(0.25,0.25,0.75),则C的原子坐标为。
③晶胞参数为a nm,则AB原子之间的距离为nm。
-
17. 硫酸镍广泛应用于电镀、电池等工业。以红土镍矿(主要成分为 , 含、、、、、、、等杂质)为原料制备,工艺流程如下。

已知:①相关金属离子形成氢氧化物沉淀的范围如下:
金属离子
开始沉淀的
6.3
1.8
3.4
8.9
6.2
6.9
沉淀完全的
8.3
3.2
4.7
10.9
8.2
8.9
②当离子完全沉淀时,。
回答下列问题:
(1)、为提高“酸溶”中镍的浸出率,可采取的措施有(写一条即可)。“滤渣1”的主要成分为。(2)、写出“硫化除铜”过程中涉及反应的离子方程式、。(3)、“氧化除杂”中加入和的作用分别是 , 溶液的应调节为~6之间。(4)、“氟化除杂”中,若 , 取等体积的溶液加入体系中发生反应,则加入的溶液的浓度至少为。[已知](5)、称取硫酸镍晶体( , 摩尔质量)样品溶于水,配成溶液。量取用标准溶液滴定,反应为。重复三次,平均消耗EDTA标准溶液 , 则样品纯度为。 -
18. ZY12201是一款新型TGR5激动剂,目前已经在体外、体内实验上证明了对糖尿病治疗的有效性。其合成路线如下:

已知:①
②
回答下列问题:
(1)、B中官能团的名称为 , G的结构简式为。(2)、的化学方程式为 , 的反应类型为。(3)、符合下列条件的A的同分异构体有种。a.含有苯环,且苯环上只有两个对位取代基;
b.遇溶液显紫色;
c.能与碳酸氢钠溶液反应产生二氧化碳气体。
(4)、结合题目信息,写出以 和溴丙烷为原料制备
和溴丙烷为原料制备 的合成路线。
的合成路线。 -
19. 三水合草酸合铁(Ⅲ)酸钾{ , x、y均为整数}常用于化学光量计。实验室用(易潮解,易升华)和为原料制备,实验步骤如下:
I.无水的制备:


 (1)、仪器连接顺序为(仪器不重复使用)。(2)、B中冷水的作用为。(3)、Ⅱ.三水合草酸合铁(Ⅲ)酸钾晶体的制备:
(1)、仪器连接顺序为(仪器不重复使用)。(2)、B中冷水的作用为。(3)、Ⅱ.三水合草酸合铁(Ⅲ)酸钾晶体的制备:称取一定质量草酸钾固体,加入蒸馏水,加热。溶解。时,边搅拌边向草酸钾溶液中加入过量溶液。将上述溶液置于冰水中冷却至绿色晶体析出。用布氏漏斗过滤、乙醇洗涤、干燥得三水合草酸合铁酸钾晶体。整个过程需避光。
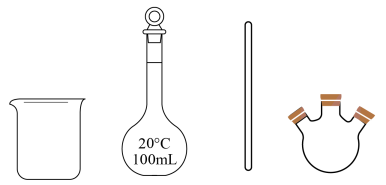
用无水配制所需溶液,下列仪器中不需要的是(填仪器名称)。
 (4)、乙醇代替水洗涤的目的是。(5)、Ⅲ.晶体组成的测定及误差分析
(4)、乙醇代替水洗涤的目的是。(5)、Ⅲ.晶体组成的测定及误差分析取少量晶体配成溶液,用标准酸性高锰酸钾溶液进行第一次滴定,达终点时消耗标准液,向滴定后的溶液中加入过量锌粒将还原为。过滤,用该高锰酸钾溶液进行第二次滴定,终点时消耗标准液(杂质不反应)。
第二次滴定时的离子反应方程式为。
(6)、中。下列情况会导致y偏高的是。(填标号)。A.样品中含有草酸钾杂质
B.第一次滴定前尖嘴有气泡,滴定后气泡消失
C.第二次滴定终点读数时仰视
D.第二次滴定终点时颜色为深紫红色
-
20. 与的干法重整(DRM)反应可同时转化两种温室气体,并制备CO和。主要反应如下:
反应I:;
反应Ⅱ:;
反应Ⅲ:
已知:反应I、Ⅱ的自发均需高温条件。
(1)、上述三个反应的平衡常数、与温度T关系如图1所示。图中a点代表的是(填“Ⅰ”、“Ⅱ”或“Ⅲ”)反应的 , 。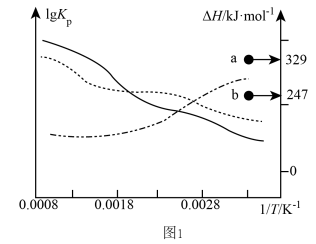 (2)、向密闭容器中,通入和 , 若仅考虑上述反应,平衡时、、、的物质的量随温度T的变化如图2所示。
(2)、向密闭容器中,通入和 , 若仅考虑上述反应,平衡时、、、的物质的量随温度T的变化如图2所示。
时,的物质的量分数为 , 用各物质的物质的量分数表示反应Ⅲ的平衡常数。后随温度升高,物质的量减少的原因为。
(3)、DRM反应目前普遍存在的一个难题是积碳,该过程与两个反应有关①;②。目前积碳问题的解决方案主要有两种: A.提高原料气中的占比;B.在常规的催化剂中添加 , 使其在催化剂表面与形成共熔物。试解释这两种方法可以有效抑制积碳的原因(答出两条即可)。(4)、使用复合催化剂,可显著提高二氧化碳的转化率,实现碳氢分离,并得到富含的产物,催化机理如图3所示。请用化学方程式解释循环的原理。
