宁夏吴忠市2023届高三下学期一轮联考理科综合化学试题
试卷更新日期:2023-03-29 类型:高考模拟
一、单选题
-
1. 新冠肺炎疫情出现以来,一系列举措体现了中国力量。在各种防护防控措施中,化学知识起到了重要作用。下列有关说法错误的是A、“ 84 消毒液”(主要成分NaClO) 消毒是利用ClO- 的强氧化性,高温消毒是利用高温可使蛋白质发生变性 B、新冠病毒(直径大约在60 ~ 140 nm),扩散到空气中不可能形成胶体,酒精杀菌消毒不可能发生化学变化 C、N95 型口罩的核心材料是聚丙烯,属于有机高分子材料 D、医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃2. 设NA是阿伏加德罗常数的值。下列说法正确的是A、39gNa2S和Na2O2组成的混合物中,含有阴离子的数目为NA B、将2molNO和1molO2混合,所得混合气体的分子总数为2NA C、31g白磷含P-P键数为1.5NA D、0.1mol/L的NaOH水溶液中含有Na+数目为0.01NA3. 一种长效、缓释阿司匹林(有机物L)的结构如图所示:

下列分析错误的是
A、有机物L为高分子化合物 B、1mol有机物L最多能与2nmolNaOH反应 C、有机物L能发生加成、取代、水解反应 D、有机物L在体内可缓慢水解,逐渐释放出 4. 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法正确的是
4. 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若Z原子序数是Y的两倍,则下列说法正确的是 A、X元素的简单氢化物分子内可以形成氢键 B、Y元素与X、Z、W元素均可形成两种以上的化合物,且都能溶于水 C、最高价氧化物对应水化物的酸性:Z>W D、阴离子半径由大到小的顺序为:Z>W>X>Y5. 下列除杂方案错误的是
A、X元素的简单氢化物分子内可以形成氢键 B、Y元素与X、Z、W元素均可形成两种以上的化合物,且都能溶于水 C、最高价氧化物对应水化物的酸性:Z>W D、阴离子半径由大到小的顺序为:Z>W>X>Y5. 下列除杂方案错误的是选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
乙酸乙酯
乙酸
氢氧化钠
分液
B
MgCl2(aq)
Fe3+(aq)
MgO(s)
过滤
C
CO2(g)
SO2(g)
饱和NaHCO3、浓H2SO4
洗气
D
Na2CO3(s)
NaHCO3(s)
/
加热
A、A B、B C、C D、D6. Mg-VOCl2电池是一种基于阴离子传导的新型二次电池,其简化装置示意图如下。总反应为Mg+2VOCl2MgCl2+2VOCl,下列说法错误的是 A、采用Mg作电极材料比Li的安全性更高 B、放电时正极反应为VOCl2+e−=VOCl+Cl− C、放电过程中Cl−穿过复合离子液体向Mg移动 D、为该电池充电时Mg电极应与电源的正极相连7. 在25 ℃时,将1.0 L x mol·L-1CH3COOH溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量变化如图所示。下列叙述错误的是
A、采用Mg作电极材料比Li的安全性更高 B、放电时正极反应为VOCl2+e−=VOCl+Cl− C、放电过程中Cl−穿过复合离子液体向Mg移动 D、为该电池充电时Mg电极应与电源的正极相连7. 在25 ℃时,将1.0 L x mol·L-1CH3COOH溶液与0.1 mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量变化如图所示。下列叙述错误的是 A、水的电离程度:a>b>c B、a点对应的混合溶液中:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) C、b点对应的混合溶液中:c(CH3COOH)= mol·L-1 D、该温度下,CH3COOH的电离平衡常数均为Ka=
A、水的电离程度:a>b>c B、a点对应的混合溶液中:c(CH3COO-)=c(Na+)>c(OH-)=c(H+) C、b点对应的混合溶液中:c(CH3COOH)= mol·L-1 D、该温度下,CH3COOH的电离平衡常数均为Ka=二、非选择题
-
8. 硫酸锰是一种重要的化工中间体。一种以高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿(主要成分为MnO2等锰的氧化物)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中沉淀的pH范围如下表所示(25℃):
物质
Fe(OH)3
Fe(OH)2
Mn(OH)2
Al(OH)3
开始沉淀的pH
1.9
7.6
7.3
3.0
完全沉淀的pH
3.2
9.6
9.3
5.2
③离子浓度≦10-5mol·L-1时,离子沉淀完全。
(1)、“混合焙烧”的主要目的是。(2)、若试剂a为MnO2 , 则氧化步骤发生反应的离子方程式为 , 若省略“氧化”步骤,造成的影响是。(3)、“中和除杂”时,应控制溶液的pH范围是。(4)、“氟化除杂”后,若使溶液中Mg2+沉淀完全,需维持c(F-)不低于。(已知:Ksp(MgF2)=6.4×10-10)(5)、“碳化结晶”时发生反应的离子方程式为 , 最后一步系列操作主要是。9. Cl2常用作自来水消毒剂,Cl2作消毒剂时生成的有机氯化物可能对人体有害。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)。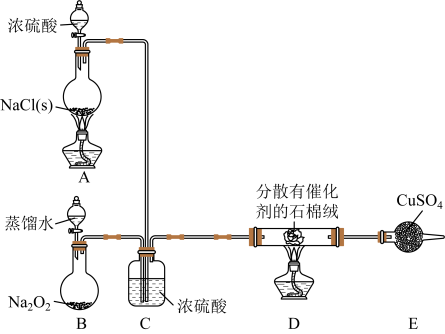
请回答下列问题:
(1)、A装置中反应利用了浓硫酸的难挥发性,则该反应的化学方程式为。(2)、当B装置中反应转移0.08mol电子时,则消耗的Na2O2固体的质量为。(3)、C装置的作用。(4)、反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为。(5)、ClO2的制备方法比较实用的有数十种,下列方法是常见方法之一。方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
当有0.4mol电子发生转移时,得到的还原产物为mol。
方法二:实验室常用氯酸钾(KClO3)、草酸(H2C2O4)和硫酸溶液共热制备。有同学设计如下装置制备ClO2并用其处理含锰离子的工业废水。
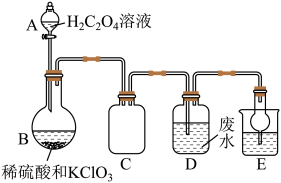
①C装置的作用为。
②B中反应的离子方程式:。
10. 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g),ΔH2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g),ΔH3=-90.77kJ·mol-1
回答下列问题:
(1)、反应Ⅱ的ΔH2=。(2)、反应Ⅲ能够自发进行的条件是。(填“较低温度”“较高温度”或“任何温度”)。(3)、恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是____。A、混合气体的密度不再变化 B、混合气体的平均相对分子质量不再变化 C、CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 D、甲醇的百分含量不再变化(4)、对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法错误的是____。 A、其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1 B、温度低于250℃时,随温度升高甲醇的产率增大 C、M点时平衡常数比N点时平衡常数大 D、实际反应应尽可能在较低的温度下进行,以提高CO2的转化率(5)、若在1 L密闭容器中充入2.5 molH2和1 molCO2发生反应I,则图中M点时,产物甲醇的体积分数为 , 该温度下反应的平衡常数K=。(6)、已知下列物质在20℃下的Ksp如下,试回答下列问题:
A、其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1 B、温度低于250℃时,随温度升高甲醇的产率增大 C、M点时平衡常数比N点时平衡常数大 D、实际反应应尽可能在较低的温度下进行,以提高CO2的转化率(5)、若在1 L密闭容器中充入2.5 molH2和1 molCO2发生反应I,则图中M点时,产物甲醇的体积分数为 , 该温度下反应的平衡常数K=。(6)、已知下列物质在20℃下的Ksp如下,试回答下列问题:化学式
AgCl
AgBr
AgI
Ag2S
Ag2CrO4
颜色
白色
浅黄色
黄色
黑色
红色
Ksp
1.8×10-10
5.4×10-13
8.3×10-17
6.3×10-50
2.0×10-12
①向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时=。
②测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是。
A.KBr B.KI C.K2S D.K2CrO4
11. 阿散酸( )是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题: (1)、基态As原子核外电子排布式为 , As的第一电离能比Se的大的原因为。(2)、的中心原子的杂化方式为 , 的空间构型为。(3)、与互为等电子体的分子为(填化学式,任写一种即可)。(4)、液氨可作制冷剂,汽化时吸收大量的热的原因是。(5)、NaCl晶体在50~-300GPa的高压下和Na或Cl2反应,可以形成不同的晶体,其中一种晶体的晶胞如图1所示,该晶体的化学式为。
)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题: (1)、基态As原子核外电子排布式为 , As的第一电离能比Se的大的原因为。(2)、的中心原子的杂化方式为 , 的空间构型为。(3)、与互为等电子体的分子为(填化学式,任写一种即可)。(4)、液氨可作制冷剂,汽化时吸收大量的热的原因是。(5)、NaCl晶体在50~-300GPa的高压下和Na或Cl2反应,可以形成不同的晶体,其中一种晶体的晶胞如图1所示,该晶体的化学式为。 (6)、已知NaCl晶胞(如图2)中Na+和Cl-间最短距离为acm,阿伏加德罗常数的值为NA , NaCl晶体的密度为g·cm-3.12. 2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他作出的卓越贡献.烯烃复分解反应原理如下:C2H5CH=CH2+CH2=CHCH3C2H5CH=CH2+CH2=CHCH3。现以烯烃C5H10为原料,合成有机物M和N,合成路线如图:
(6)、已知NaCl晶胞(如图2)中Na+和Cl-间最短距离为acm,阿伏加德罗常数的值为NA , NaCl晶体的密度为g·cm-3.12. 2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他作出的卓越贡献.烯烃复分解反应原理如下:C2H5CH=CH2+CH2=CHCH3C2H5CH=CH2+CH2=CHCH3。现以烯烃C5H10为原料,合成有机物M和N,合成路线如图: (1)、有机物A的结构简式为。(2)、按系统命名法,B的名称是。(3)、B→C的反应类型是。(4)、写出D→M的化学方程式。(5)、满足下列条件的X的同分异构体共有种,写出任意一种的结构简式。
(1)、有机物A的结构简式为。(2)、按系统命名法,B的名称是。(3)、B→C的反应类型是。(4)、写出D→M的化学方程式。(5)、满足下列条件的X的同分异构体共有种,写出任意一种的结构简式。①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有两种
(6)、写出E→F合成路线(在指定的3个方框内写有机物,有机物用结构简式表示,箭头上注明试剂和反应条件,若出现步骤合并,要标明反应的先后顺序)。→→→
