辽宁省县级重点高中联合体2023届高三第一次模拟考试化学试题
试卷更新日期:2023-03-29 类型:高考模拟
一、单选题
-
1. “华龙一号”是我国具有完全自主知识产权的三代压水堆核电创新成果,其安全性高、发电能力强。下列相关叙述错误的是
 A、“华龙一号”海外投产,有利于实现碳达峰、碳中和的目标 B、核电站以铀为核裂变原料,与互为同素异形体 C、核燃料包壳使用锆合金制造,合金中可以含有非金属元素 D、核电6号机浇筑用的水泥属于硅酸盐材料2. 下列化学用语表示正确的是A、的结构式为H-O-H,结构呈直线形 B、基态Cu原子的电子排布式: C、的电子式:
A、“华龙一号”海外投产,有利于实现碳达峰、碳中和的目标 B、核电站以铀为核裂变原料,与互为同素异形体 C、核燃料包壳使用锆合金制造,合金中可以含有非金属元素 D、核电6号机浇筑用的水泥属于硅酸盐材料2. 下列化学用语表示正确的是A、的结构式为H-O-H,结构呈直线形 B、基态Cu原子的电子排布式: C、的电子式: D、在水中的电离方程式:
3. 关于安全问题的应对措施,下列说法错误的是A、氰化钠(NaCN)有剧毒,不慎泄漏,可喷洒双氧水处理 B、误食中毒,可以用5%的硫酸钠溶液洗胃解毒 C、皮肤受伤时,可以用75%的乙醇溶液消毒处理,利用的是乙醇的氧化性 D、苯酚对皮肤有腐蚀性,不慎沾到皮肤上,应立即用酒精冲洗,再用水冲洗4. 设为阿伏加德罗常数的值。下列叙述正确的是A、20g中含有的中子数为10 B、5.6gFe在氧化还原反应中完全反应时转移的电子数一定为0.3 C、1L0.1溶液中含有的数目为0.1 D、1mol环戊二烯(
D、在水中的电离方程式:
3. 关于安全问题的应对措施,下列说法错误的是A、氰化钠(NaCN)有剧毒,不慎泄漏,可喷洒双氧水处理 B、误食中毒,可以用5%的硫酸钠溶液洗胃解毒 C、皮肤受伤时,可以用75%的乙醇溶液消毒处理,利用的是乙醇的氧化性 D、苯酚对皮肤有腐蚀性,不慎沾到皮肤上,应立即用酒精冲洗,再用水冲洗4. 设为阿伏加德罗常数的值。下列叙述正确的是A、20g中含有的中子数为10 B、5.6gFe在氧化还原反应中完全反应时转移的电子数一定为0.3 C、1L0.1溶液中含有的数目为0.1 D、1mol环戊二烯( )分子中含有的键数目为5
5. 下列离子方程式正确的是A、Na投入水中: B、通入冷的NaOH溶液中: C、用醋酸和淀粉—KI溶液检验加碘盐中的: D、溶液与少量溶液混合:6. 推理是学习化学的一种重要方法,下列推理中正确的是
)分子中含有的键数目为5
5. 下列离子方程式正确的是A、Na投入水中: B、通入冷的NaOH溶液中: C、用醋酸和淀粉—KI溶液检验加碘盐中的: D、溶液与少量溶液混合:6. 推理是学习化学的一种重要方法,下列推理中正确的是选项
已知
推理
A
可以溶于NaOH溶液
也可以溶于NaOH溶液
B
同种元素原子的质子数相同
质子数相同的原子一定属于同种元素
C
由同种分子构成的物质一定是纯净物
纯净物一定是由同种分子构成的
D
将通入紫色石蕊试液中,试液变红
是一种酸
A、A B、B C、C D、D7. 工业上制备粗硅的反应为 , 若C过量,还会生成SiC.下列叙述错误的是A、1个CO分子内只含有1个键和2个键 B、键能:C-H>Si-H,因此甲硅烷没有甲烷稳定 C、键长:C-Si<Si-Si,因此熔点:SiC>Si D、键长:C-C<Si-Si,因此C的还原性大于Si的还原性8. β—生育酚是天然维生素E的一种水解产物,具有较高的生物活性,其结构简式如图。下列有关β—生育酚的说法正确的是 A、1个该分子中含有18个碳原子 B、该分子中含有3种官能团 C、可发生取代反应和氧化反应 D、环上的一氯代物只有1种9. 短周期主族元素X、Y、Z、W的原子序数依次增大,Y和W位于同族,一种化合物的结构如图所示。下列叙述正确的是
A、1个该分子中含有18个碳原子 B、该分子中含有3种官能团 C、可发生取代反应和氧化反应 D、环上的一氯代物只有1种9. 短周期主族元素X、Y、Z、W的原子序数依次增大,Y和W位于同族,一种化合物的结构如图所示。下列叙述正确的是 A、298K时,最简单氢化物水溶液的pH:X>Z B、第一电离能:Y>Z C、该化合物中Z的化合价最高 D、在水溶液中,四种元素均能形成简单的阴离子10. 乙醇和乙酸在酸性条件下生成乙酸乙酯,反应机理如图,下列说法错误的是
A、298K时,最简单氢化物水溶液的pH:X>Z B、第一电离能:Y>Z C、该化合物中Z的化合价最高 D、在水溶液中,四种元素均能形成简单的阴离子10. 乙醇和乙酸在酸性条件下生成乙酸乙酯,反应机理如图,下列说法错误的是 A、Ⅰ→Ⅱ形成配位键,Ⅴ→Ⅵ断裂配位键 B、Ⅱ→Ⅲ的反应的原子利用率为100% C、Ⅲ→Ⅳ质子发生转移 D、若反应条件为浓硫酸,只能加快反应速率,不能提高乙酸乙酯的平衡产率11. 下列实验操作能达到实验目的的是
A、Ⅰ→Ⅱ形成配位键,Ⅴ→Ⅵ断裂配位键 B、Ⅱ→Ⅲ的反应的原子利用率为100% C、Ⅲ→Ⅳ质子发生转移 D、若反应条件为浓硫酸,只能加快反应速率,不能提高乙酸乙酯的平衡产率11. 下列实验操作能达到实验目的的是选项
实验目的
实验操作
A
制备并收集
加热试管中的固体,并用向下排空气法收集气体
B
证明被氧化为
向双氧水中通入气体,再向反应后的溶液中滴加氯化钡溶液
C
检验淀粉是否完全水解
向淀粉溶液中滴加稀硫酸,充分加热一段时间后,加入过量氢氧化钠溶液,再滴入几滴碘水
D
证明酸性:苯酚<碳酸
将盐酸与碳酸氢钠混合产生的气体直接通入苯酚钠溶液中
A、A B、B C、C D、D12. 一种制备蓝氢的原理是。向一体积为1L的恒容密闭容器中充入1mol和2mol , 在一定条件下发生上述反应,测得的物质的量与时间的关系如表所示。下列叙述错误的是t/min
0
5
10
15
20
25
/mol
0
0.5
0.75
0.85
0.9
0.9
A、0~10min, B、CO的体积分数不变时,反应达到平衡状态 C、上述反应中,的转化率大于的转化率 D、其他条件不变。若加入高效催化剂,则的转化率达到45%时所用时间小于20min13. 某立方品系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构,图b表示晶胞的一部分,晶胞中1号、3号原子的分数坐标分别为(0,0,0)、(1,1,1)。下列说法错误的是 A、晶胞中含有的Sb原子数为4 B、2号原子的分数坐标为 C、K和Sb之间的最短距离为pm D、该晶体的密度为14. 某团队开发出了用于制氢的膜基海水电解槽,其装置如图所示。已知:隔水膜只允许水分子透过。下列说法正确的是
A、晶胞中含有的Sb原子数为4 B、2号原子的分数坐标为 C、K和Sb之间的最短距离为pm D、该晶体的密度为14. 某团队开发出了用于制氢的膜基海水电解槽,其装置如图所示。已知:隔水膜只允许水分子透过。下列说法正确的是 A、M极为阳极 B、理论上迁移1mol时,海水质量净减9g C、M极的电极反应式为 D、电路上每通过2mol电子,理论上N极逸出标准状况下22.4L15. 常温下,水溶液中部分缓冲对的微粒浓度之比的对数值[x表示或]与溶液pH的关系如图所示。下列说法错误的是
A、M极为阳极 B、理论上迁移1mol时,海水质量净减9g C、M极的电极反应式为 D、电路上每通过2mol电子,理论上N极逸出标准状况下22.4L15. 常温下,水溶液中部分缓冲对的微粒浓度之比的对数值[x表示或]与溶液pH的关系如图所示。下列说法错误的是 A、曲线Ⅰ表示与溶液pH的变化关系 B、 C、a→b的过程中,水的电离程度逐渐减小 D、当pH增大时,的值逐渐增大
A、曲线Ⅰ表示与溶液pH的变化关系 B、 C、a→b的过程中,水的电离程度逐渐减小 D、当pH增大时,的值逐渐增大二、非选择题
-
16. 工业上以软锰矿(主要成分为 , 还含少量的铁、硅和铝的氧化物等杂质)为原料生产的工艺流程如图:

常温下,各种离子沉淀时的pH如下表:
离子
开始沉淀时的pH
1.5
3.4
8.2
完全沉淀时的pH
2.8
4.7
10.2
(1)、“酸浸”过程中生成一种黄色沉淀,写出该反应的离子方程式: , “滤渣Ⅰ”的主要成分有。(2)、“工序①”需要用到的玻璃仪器为烧杯、。(3)、向“有机相”中滴加溶液,有蓝色沉淀生成,可推出“有机相”中含(填离子符号),中提供空轨道的是 , 中心离子的配位数为。(4)、“沉锰”时,不能加入太多碳酸钠溶液,可能的原因为(答两条)。(5)、若100kg软锰矿在生产过程中锰的损失率为8%,最终得到405kg(摩尔质量为285),则软锰矿中锰的质量分数约为(保留三位有效数字)。17. 将转化为有机碳酸酯(DMC),可有效减少碳排放。转化为DMC的总反应为 , 可通过Ⅰ、Ⅱ两步反应完成:Ⅰ.
Ⅱ.
请回答下列问题:
(1)、有机碳酸酯中碳原子的杂化方式为 , 1mol中含有的键数目为。(2)、反应Ⅱ的反应机理如图1所示,其中催化剂参与催化循环和脱水循环。
①该反应的催化剂是 , 该物质还有另一个作用一提高DMC的平衡产率,结合反应机理图分析其中的原因:。
②将物质的量之比为1∶2的和的混合气体以相同流速通过两种不同的催化剂a、b,仅发生反应Ⅱ.相同时间内的转化率如图2所示。

M点(填“是”或“不是”)对应温度下的的平衡转化率,原因是。
(3)、一定温度范围内的线性关系如图3。①对于反应Ⅱ,活化能(填“>”或“<”)。
②时,该温度下。某温度下,在5L恒容密闭容器中充入5mol和10mol , 发生反应Ⅰ、Ⅱ,反应经10min达到平衡,此时 , , 则
18. 硫酸亚铁铵晶体[]又称摩尔盐,简称FAS,是一种重要的化工原料,可用作净水剂、治疗缺铁性贫血的药物等,常温下为浅绿色晶体,可溶于水,100℃时易失去结晶水。实验室利用废铁屑(主要成分为Fe,还有少量FeS和油污)合成硫酸亚铁铵晶体的步骤如下:Ⅰ.碱煮水洗:将6.0g废铁屑置于锥形瓶中,加入20mL30%的溶液,加热煮沸一段时间,倾去溶液,水洗至中性;
Ⅱ.的制备:向处理过的铁屑中加入稀反应,结束后趁热过滤;
Ⅲ.硫酸亚铁铵晶体的制备:向滤液中迅速加入一定体积的饱和溶液,经蒸发皿加热至出现晶膜时停止加热,冷却结晶硫酸亚铁铵晶体,再过滤、洗涤、干燥得到产品。
回答下列问题:
(1)、步骤Ⅰ中对废铁屑进行碱煮的目的是。(2)、步骤Ⅱ在如图装置中进行,为加快反应速率,控制温度在70~75℃,对装置A加热的方式为 , 装置C的作用为 , 该步骤不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是。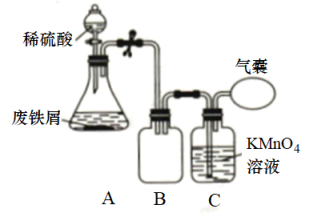 (3)、步骤Ⅲ制取硫酸亚铁铵晶体的反应中硫酸需过量,保持溶液的pH在1~2,其目的为 , 通过冷却结晶的方法,能够析出硫酸、亚铁铵晶体的原因可能是。(4)、测定硫酸亚铁铵晶体样品的纯度:
(3)、步骤Ⅲ制取硫酸亚铁铵晶体的反应中硫酸需过量,保持溶液的pH在1~2,其目的为 , 通过冷却结晶的方法,能够析出硫酸、亚铁铵晶体的原因可能是。(4)、测定硫酸亚铁铵晶体样品的纯度:准确称量20.00g硫酸亚铁铵晶体样品,配制成100mL溶液。取所配溶液25.00mL于锥形瓶中,加稀酸化,用0.1000标准溶液滴定至终点,重复两次,平均消耗标准溶液18.00mL。
①判断达到滴定终点的标志是。
②样品中的质量分数为。
已知的。
(5)、某实验小组通过下列装置探究硫酸亚铁铵晶体和绿矾晶体()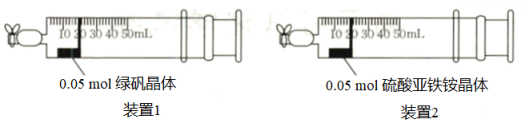
向两支注射器中分别放入0.05mol的绿矾晶体和硫酸亚铁铵晶体,向右侧拉动注射器活塞,各吸入20mL空气后关闭注射器针头处的夹子(密封性良好),放置一段时间后,取出两种晶体,用无氧蒸馏水溶解配成等体积的溶液,向溶液中各滴加几滴KSCN溶液。
①获得无氧蒸馏水的方法为。
②若硫酸亚铁铵晶体的抗氧化能力强,则放置一段时间后,活塞向左移动的距离较长的是(填“装置1”或“装置2”)。
19. 一种药物中间体G的合成路线如图:
已知:①DMF的结构简式为
 ;
;②。
(1)、的名称为;已知A→B的反应中有可燃性气体生成,试写出其化学方程式:。(2)、C→D的反应过程可分为两步,其中间产物H的结构为 , 该物质中的含氧官能团的名称为 , H→D的反应类型为。 (3)、检验C中含氧官能团的试剂为;F的结构简式为。(4)、分子式比G少一个氧原子的有机物中,含有萘环(
, 该物质中的含氧官能团的名称为 , H→D的反应类型为。 (3)、检验C中含氧官能团的试剂为;F的结构简式为。(4)、分子式比G少一个氧原子的有机物中,含有萘环( ),且只含有两个相同取代基的结构有种,其中核磁共振氢谱吸收峰面积之比为2∶2∶1∶1∶1的结构简式为(写出一种)。
),且只含有两个相同取代基的结构有种,其中核磁共振氢谱吸收峰面积之比为2∶2∶1∶1∶1的结构简式为(写出一种)。