河南省濮阳市2023届高三第一次摸底考试理科综合化学试题
试卷更新日期:2023-03-29 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关。下列说法中的因果关系正确的是
选项
原因
结果
A
草酸钙是人体不能吸收的沉淀物
卤水豆腐不可与菠菜一起煮
B
三氯化铁具有氧化性
三氯化铁可作净水剂
C
聚氯乙烯塑料稳定性比聚乙烯塑料强
用聚氯乙烯塑料袋来盛装食品
D
天然气含碳量比液化石油气低
燃气灶将天然气改为液化石油气时需增大空气进入量
A、A B、B C、C D、D -
2. 我国科学家实现了从二氧化碳到淀粉的合成过程,其中涉及如下转化反应:

下列说法正确的是
A、甲和乙互为同系物 B、乙在Cu存在下与O2加热反应生成只有一种官能团的有机物 C、乙不能与H2发生加成反应 D、1 mol 乙与足量的Na反应生成1 mol H2 -
3. 有一包固体粉末,由NaOH、Na2SO3、MgCl2、CaCO3、Ba( NO3)2、FeSO4中的几种组成,取少量样品进行如下实验:
①将样品加入水中,得到白色不溶物a和无色溶液
②向①中加入足量稀盐酸,产生气体,仍存在不溶物
该固体粉末一定含有的是
A、CaCO3、Ba( NO3)2 B、CaCO3、Na2SO3 C、Na2SO3、Ba( NO3)2 D、CaCO3、Na2SO3、Ba( NO3)2 -
4. 利用如图所示装置进行下列实验(部分夹持和尾气处理装置省略),相应实验现象描述正确的是

选项
Ⅰ处试剂
Ⅱ处用品
Ⅱ处实验现象
A
NH4Cl
湿润的蓝色石蕊试纸
Ⅰ处产生白烟,Ⅱ处蓝色石蕊试纸变红
B
Cu2( OH)2CO3
过氧化钠粉末
Ⅰ处由绿色变黑色,Ⅱ处由淡黄色变白色
C
KClO3
湿润的淀粉试纸
Ⅰ处无明显现象,Ⅱ处淀粉试纸变蓝
D
氧化铁和碳粉的混合物
氧化铜粉末
Ⅰ处由黑色变银白色,Ⅱ处由黑色变红色
A、A B、B C、C D、D -
5. 化合物M[化学式为RQ4Y(ZX4)2·12Q2X]曾是一种食品添加剂,现已被禁用。Q、R、X、Y、Z 元素分别处于三个短周期,原子序数依次增加,且和为45。在元素周期表中X与R 、Z相邻。下列叙述正确的是
 A、简单离子半径:R>X>Y>Z B、Q与X的二元简单化合物比Q与R的二元简单化合物沸点高、热稳定性强 C、X与R或Z组成的二元化合物均为酸性氧化物 D、向一定体积的M溶液中滴加等浓度的Ba(OH)2溶液,生成沉淀质量的曲线如图所示
A、简单离子半径:R>X>Y>Z B、Q与X的二元简单化合物比Q与R的二元简单化合物沸点高、热稳定性强 C、X与R或Z组成的二元化合物均为酸性氧化物 D、向一定体积的M溶液中滴加等浓度的Ba(OH)2溶液,生成沉淀质量的曲线如图所示 -
6. 1971年Tekkosha公司利用金属钠可溶于水银形成液态的合金“钠汞齐”这一性质,通过电解饱和食盐水得到金属钠,制取钠汞齐的实验装置如图所示。下列说法错误的是
 A、b电极是阴极 B、若没有玻璃套管,b电极反应式为2H2O +2e-= H2 ↑+2OH- C、电解过程中玻璃套管下端的银白色液面上升 D、水银层的质量每增加0.23 g, 理论上c口会逸出112 mL气体
A、b电极是阴极 B、若没有玻璃套管,b电极反应式为2H2O +2e-= H2 ↑+2OH- C、电解过程中玻璃套管下端的银白色液面上升 D、水银层的质量每增加0.23 g, 理论上c口会逸出112 mL气体 -
7. H2R为某二元有机弱酸。常温下,在保持c(HR-) =0.01 mol·L-1的Na2R和NaHR的混合溶液中,若用pR、pH2R表示-lgc(R2-)、-lg c( H2R) ,则不同溶液中的pR或pH2R与pH的关系曲线如图所示。下列说法中正确的是
 A、XY所在的曲线是pR与pH的关系曲线 B、常温下,Ka2 (H2R)的数量级为10-5 C、Y点对应的pH =4.7 D、溶液中存在c(R2-) ·c(H2R) =10 -7
A、XY所在的曲线是pR与pH的关系曲线 B、常温下,Ka2 (H2R)的数量级为10-5 C、Y点对应的pH =4.7 D、溶液中存在c(R2-) ·c(H2R) =10 -7
二、非选择题
-
8. 稀有金属元素铼(Re)和锰同族,铼和钛是航天不可缺少的材料。某烟道灰的主要成分为Re2O7、TiO2、SiO2、CuO、 Fe2O3 , 从中提取铼粉和钛的流程如图所示:

已知:铼的最高价氧化物为酸性氧化物,能与水反应生成对应的酸。在碱性溶液中, 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成。
回答下列问题:
(1)、晶体主要成分的化学式中含有7个结晶水,其化学式是。(2)、“碱浸”过程发生反应的离子方程式是。(3)、“氧化溶解”过程中Re(OH)4转化为 ,该反应中还原剂与氧化剂的物质的量之比为。(4)、“酸溶”过程得到的钛在溶液中以TiO2+形式存在,其“水解”反应的离子方程式为。(5)、“转化”过程中加入Fe的作用是。(6)、“冶钛”过程中将TiO2先转化为TiCl4再用Mg进行还原,写出高温条件下用Mg还原TiCl4的化学方程式:。 -
9. 碳酸乙烯酯( EC)是一种性能优良的溶剂和精细化工中间体,是有机化工潜在的基础原料。EC的熔点为36℃,沸点为243℃,相对密度为1.4259g·cm-3。某课外小组拟用下图装置在100 ~120℃下以NY -2作催化剂,环氧乙烷( EO)和CO2为原料合成EC。

其反应原理为主反应:

副反应:

回答下列问题:
(1)、用固体NY-2配制500g 4.8%的NY-2水溶液未用到下列仪器中的(填仪器名称)。 (2)、控制装置D中反应温度的方法是(填“水浴加热”或“油浴加热”)。(3)、用装置A制备CO2时,应先打开K1和K2 , 然后。(4)、将装置C中的EO导入三颈烧瓶中的操作是 , 继续通入 CO2 , 用搅拌器搅拌,使反应物充分混合。(5)、CO2在水中的溶解度较小,但随着反应进行,从三颈烧瓶中逸出的CO2减少,其可能原因是。(6)、温度超过120℃后, EO的转化率增大,而EC的产率却减小,其可能原因是。(7)、计算结果表明,EO的转化率为91.5% ,EC的选择性为82% (EC的选择性=生成EC的物质的量/转化的EO的物质的量) ,若实验加入22 g EO,则得到g EC(结果保留两位有效数字)。
(2)、控制装置D中反应温度的方法是(填“水浴加热”或“油浴加热”)。(3)、用装置A制备CO2时,应先打开K1和K2 , 然后。(4)、将装置C中的EO导入三颈烧瓶中的操作是 , 继续通入 CO2 , 用搅拌器搅拌,使反应物充分混合。(5)、CO2在水中的溶解度较小,但随着反应进行,从三颈烧瓶中逸出的CO2减少,其可能原因是。(6)、温度超过120℃后, EO的转化率增大,而EC的产率却减小,其可能原因是。(7)、计算结果表明,EO的转化率为91.5% ,EC的选择性为82% (EC的选择性=生成EC的物质的量/转化的EO的物质的量) ,若实验加入22 g EO,则得到g EC(结果保留两位有效数字)。 -
10. 含NO的烟气需要处理后才能排放。(1)、氢气催化还原含NO的烟气,发生“脱硝”反应:2NO(g) +2H2(g) N2(g) +2H2O(g) ΔH=-605kJ·mol-1。一定条件下,加入H2的体积分数对该反应平衡时含氮物质的体积分数的影响如图所示:

①随着H2体积分数增加, NO中N被还原的价态逐渐降低。当H2的体积分数在0.5×10-3 ~ 0.75×10-3时,NO的转化率基本为100%,而N2和NH3的体积分数仍呈增加趋势,其可能原因是。
②已知:Ⅰ.4NH3(g) +5O2(g)= 4NO(g) +6H2O(g) ΔH = -1025 kJ ·mol-1
Ⅱ.2H2(g) +O2(g)= 2H2O(g) ΔH = -484 kJ ·mol-1
图中N2减少的原因是N2与H2反应生成NH3 , 写出该反应的热化学方程式:。
(2)、某科研小组研究了NO与H2反应生成N2和NH3的转化过程。在起始温度为400℃时,将n(NO):n(H2)=1:2通入甲、乙两个恒容密闭容器中,甲为绝热过程、乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
①曲线X是(填“甲”或“乙”)容器。
②a点在曲线X上,则a点是平衡点(填“可能”或“不可能”)。
③曲线Y的容器中反应达到平衡时NO的转化率为60%,从开始到平衡点Z时用分压表示的H2消耗速率是kPa·min-1。400℃时,“脱硝”反应的压强平衡常数Kp= kPa -1(结果保留两位有效数字,Kp为用分压代替浓度计算的平衡常数,分压=总压 × 物质的量分数)。
(3)、科学研究发现,用P1 -g-C3N4光催化氧化法脱除NO的过程如图所示。
光催化脱除原理和电化学反应原理类似,P1-g-C3N4光催化的P1和g-C3N4两端类似于两极,g –C3N4极发生反应( 填“氧化”或“还原”),该极的电极反应式为。
-
11. 铬是重要的金属元素之一,其化合物有着广泛的用途。回答下列问题:(1)、基态铬原子的未成对电子数是。(2)、CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7 +3CCl4=2KCl +2CrO2Cl2 +3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是 (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是 (填“平面四边形”或“四面体形”)。
(3)、三价铬丙二酸配合物[ Cr( C3H2O4)( H2O)4][Cr( C3H2O4)2(H2O)2]·4H2O在有机合成方面具有优良的催化性能,其中阴离子的结构如下:
①阴离子中碳原子的杂化轨道类型是。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是。
(4)、Cr-N系列涂层具有良好的耐磨和腐蚀性,在抗微动磨损上表现尤佳。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示: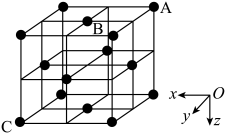
①下列为晶胞中Cr原子沿x轴方向的投影的是( 填字母)。
a.
 b.
b. 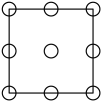 c.
c. 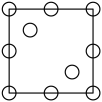 d.
d. 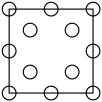
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为r(Cr) nm和r(N) nm;晶胞中N原子的坐标是A(0,0,0)、B( , , 0) ,则距A和B最近的Cr原子的坐标是 , 该原子到C原子的距离是nm[用含r(Cr)、r(N)的代数式表示]。
-
12. 有机物J是合成一种具有很强的生理活性、药理活性药物的中间体,其某种合成路线如图所示:



已知:①

②R-COOR' + R"OH R-COOR" + R'OH(其中R为H或烃基,R'、R"为烃基)
回答下列问题:
(1)、X的化学名称为;B 中含氧官能团的名称为。(2)、H →I的反应类型为。(3)、G的结构简式为。(4)、C →D的化学方程式为 , 其中浓硫酸的作用是。(5)、J有多种同分异构体,满足下列条件的同分异构体有种。①1 mol该物质与足量NaHCO3溶液反应生成44.8 L气体(标准状况) ;
②苯环有两个侧链,且均含有氧原子。
其中,核磁共振氢谱有5组峰的同分异构体的结构简式为。
