河南省平许济洛四市2023届高三下学期第二次质量检测理科综合化学试题
试卷更新日期:2023-03-29 类型:高考模拟
一、单选题
-
1. 化学与社会生产及生活密切相关,下列说法错误的是A、C919国产大飞机风挡结构部分使用的有机玻璃属于有机高分子材料 B、神舟十四号飞船外壳使用的氮化硅陶瓷属于新型无机非金属材料 C、“蛟龙”号耐压球壳釆用的钛合金材料,具有密度小、强度高、耐高温等特点 D、存放新冠疫苗使用的中硼硅玻璃瓶含有的Na2O • B2O3 • SiO2是一种复杂的氧化物
-
2. 三醋精是一种食品用香料,可通过下列反应制备。下列说法正确的是
 A、三醋精属于油脂 B、三醋精的分子式为C9H13O6 C、该反应属于加成反应 D、d的同分异构体不止一种
A、三醋精属于油脂 B、三醋精的分子式为C9H13O6 C、该反应属于加成反应 D、d的同分异构体不止一种 -
3. 短周期主族元素R、X、Y、Z原子序数依次递增,它们中的两种元素可组成化合物甲,另外两种元素可组成化合物乙。常温下,甲为液态,乙为固态。甲+乙→白色沉淀+气体(臭鸡蛋气味),Y原子的电子层数等于最外层电子数。下列说法正确的是A、原子半径Z > Y > X > R B、气态氢化物的热稳定性:X > Z C、R、X、Z只能组成一种共价化合物 D、工业上,电解熔融的氯化物制备Y的单质
-
4. 用MnO2作催化剂,氨还原脱除NO的一种反应机理示意图如下。下列说法错误的是
 A、反应过程中Mn的化合价没有发生变化 B、总反应的方程式可表示为4NH3 +4NO +O24N2 +6H2O C、MnO2能结合NH3的原因是两者形成了配位键 D、反应过程中存在极性共价键和非极性共价键的断裂和形成
A、反应过程中Mn的化合价没有发生变化 B、总反应的方程式可表示为4NH3 +4NO +O24N2 +6H2O C、MnO2能结合NH3的原因是两者形成了配位键 D、反应过程中存在极性共价键和非极性共价键的断裂和形成 -
5. 某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:下列叙述正确的是
 A、装置e 的作用是防倒吸 B、根据图a的现象判断活塞K一定处于关闭状态 C、实验结束时,先关闭活塞K,再熄灭酒精灯 D、b、c、f 中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液
A、装置e 的作用是防倒吸 B、根据图a的现象判断活塞K一定处于关闭状态 C、实验结束时,先关闭活塞K,再熄灭酒精灯 D、b、c、f 中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液 -
6. 随着中国双碳决策部署的有序推进,绿电发电规模逐年提升,为适应未来绿电长时储能需求,我国企业开始于2022年利用“全钒液流电池”布局大型储能基地。电池的充放电总反应式为VO2+ +V3+ +H2OVO2+ +V2+ +2H + , 下图为全钒液流电池工作原理示意图。下列说法错误的是
 A、放电时电极A的电势比B的高 B、放电时正极的电极反应式为VO +e-+ 2H+ =VO2+ +H2O C、在220V电压下,用恒定的1A电流充电1小时,电池中增加的化学能为7.92 105J D、充电时H +由A极室通过质子交换膜向B极室迁移
A、放电时电极A的电势比B的高 B、放电时正极的电极反应式为VO +e-+ 2H+ =VO2+ +H2O C、在220V电压下,用恒定的1A电流充电1小时,电池中增加的化学能为7.92 105J D、充电时H +由A极室通过质子交换膜向B极室迁移 -
7. 25℃时,某混合溶液中c(H2A) +c(HA-) +c(A2-) =0.01 mol/L,由水电离出的c水(H+) 的对数lgc水(H+ )与、的关系如图所示。下列说法正确的是
 A、Ka1(H2A) =10-8 B、Z点时溶液的pH=7 C、M点和N点溶液的组成完全相同 D、从X点到Y点发生的反应可能为:HA- +OH- =A2- +H2O
A、Ka1(H2A) =10-8 B、Z点时溶液的pH=7 C、M点和N点溶液的组成完全相同 D、从X点到Y点发生的反应可能为:HA- +OH- =A2- +H2O
二、非选择题
-
8. 己二酸[HOOC(CH2)4COOH]是一种十分重要的二元羧酸,主要用在合成尼龙-66、PBAT可降解塑料等生产领域。某实验室采用在碱性条件下,用高锰酸钾氧化环己醇制备己二酸,反应原理为:


已知:环己醇相对分子质量为100,熔点为24℃,沸点为161 ℃,密度为0.95 g/mL;己二酸相对分子质量为146,微溶于水,且温度越低溶解度越小。
实验步骤如下:
i.向三颈瓶中加入3. 5 g碳酸钠和50 mL温水,在搅拌下加入10 g高锰酸钾。
ii.待高锰酸钾溶解后,用滴管慢慢加入2.6 mL环己醇,维持反应温度在43〜47℃之间。
iii.环己醇滴加完毕,待反应完成,使二氧化锰沉淀凝结,然后加适量固体亚硫酸氢钠除去过量的高锰酸钾。
iv.趁热抽滤,滤渣用热水洗涤三次,合并滤液与洗涤液,用浓盐酸调pH至1〜2。
v.将滤液加热浓缩至20 mL左右,冷却,结晶,抽滤,洗涤,干燥,称重(得到产品1.5 g),计算产率。
请回答下列问题:
(1)、仪器a的名称为 , 使用时要从(填“上口 ”或“下口 ”)通入冷水。(2)、本实验中高锰酸钾也可用浓硝酸代替,但用浓硝酸代替的缺点是 。(3)、改进后的装置中,滴液漏斗b细支管的作用是。使用改进后的装置,考查了步骤ii中滴加速度分别为6、18、25 s •滴-1共3种情况下的反应状况、滤渣和滤液及产品性状。见下表所示。
滴加时间 /min
滴加速度 /(s •滴-1)
反应过程监控
滤渣
滤液
产品性状
20
6
7 min,T=100℃,发生冲料;20 min滴加完,反应完成
黑色,偏褐色,量大
澄清透明, 偏黄绿色
量少,乳白 色,稍黄
60
18
Tmax =74℃环己醇滴加完T =44℃ ,60 min反应完成
黑色固体
无色,澄清, 透明
无色晶体
90
25
13min,温度没有变化;23min,T=40℃;Tmax=53℃;环己醇滴加完,T=41℃反应不完全,水浴加热20min,反应完成
黑色固体
无色,澄清, 透明
无色片状晶体,晶型很漂亮
(4)、步骤iii中除去多余高锰酸钾的原因是。(5)、步骤v由为了除去可能的杂质和减少产品损失,可用洗涤晶体。(6)、本实验中己二酸的产率为% (保留两位有效数字)。 -
9. 二氧化铈(CeO2)是一种重要的稀土氧化物,可以用于光催化降解有机污染物,利用氟碳铈矿(主要成分为CeCO3F,含Fe2O3、FeO等杂质)制CeO2的工艺流程如下:

已知:①滤渣I主要成分是难溶于水的Ce(BF4)3;
②常温下,Ka1(H2CO3) =4.3×10-7 , Ka2(H2CO3) =5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×1.0-28;
③Ce3 +在空气中易被氧化为Ce4+。
回答下列问题:
(1)、CeCO3中Ce元素的化合价为。(2)、焙烧氟碳铈矿时,提高焙烧效率的措施有(写出两种);实验室进行焙烧操作时一般在中进行。(3)、CeCO3F在焙烧时发生反应的化学方程式为。(4)、上述流程中所加的盐酸要适当过量,其目的是;操作中可用硫酸和H2O2替换盐酸,其优点是。(5)、写出从滤液II中沉淀铈的离子方程式。Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol/L]时溶液的pH为5,则溶液中c()=mol/L(保留两位有效数字)。 -
10. 为全面实现碳达峰和碳中和,碳及其化合物的资源化利用成为研究热点。 回答下列问题:(1)、CO2和H2反应可生成甲醇。已知101 kPa和298 K时一些物质的标准摩尔生成热(在101 kPa和一定温度下,由最稳定单质生成1 mol纯物质的热效应,称为该物质的标准摩尔生成热)数据如表所示:
物质
H2(g)
CO2(g)
CH3OH(g)
H2O(g)
(kJ·mol -1)
0
- 393.5
- 201
- 241.8
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH= kJ• mol-1。
②在一定条件下,向恒容密闭容器中充入1 mol CO2和3 mol H2 , 发生反应①,测得在相同时间内,不同条件下H2的转化率如图1所示(在实验条件下催化剂不会失活),b点前L1 高于L2 , b点后L1和L2重合,其原因可能是;T2时,若起始压强为15 atm,Kp=atm-2(结果保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。

③已知速率方程v正=k正c(CO2)·c3(H2),v逆=k逆c(CH3OH)• c (H2O),k正、k逆是速率常数,只受温度影响,图2表示速率常数的对数lgA与温度的倒数之间的关系,A、B、D、E分别代表图1中a点、c点的速率常数,点表示a点的lgk正。
 (2)、借助下图电解装置,二氧化碳也能生成甲醇,控制在一定温度,持续通入二氧化碳,电解过程中物质的量基本不变,则阴极电极反应式为。
(2)、借助下图电解装置,二氧化碳也能生成甲醇,控制在一定温度,持续通入二氧化碳,电解过程中物质的量基本不变,则阴极电极反应式为。 (3)、CO2和C2H6在催化剂作用下可以合成C2H4 , 反应为:CO2(g)+C2H6(g)CO(g)+H2O(g)+C2H4(g) ΔH=+177 kJ•mol-1 , 在C2H4合成体系内会发生副反应。
(3)、CO2和C2H6在催化剂作用下可以合成C2H4 , 反应为:CO2(g)+C2H6(g)CO(g)+H2O(g)+C2H4(g) ΔH=+177 kJ•mol-1 , 在C2H4合成体系内会发生副反应。①若发生副反应C2H6(g)3H2(g)+2C(s),会降低催化效率,原因是。
②某温度下,若只存在副反应:2CO2(g)+C2H6(g)4CO(g)+3H2(g)。向a L密闭容器中充入2.1 mol C2H6和2.2 mol CO2 , t min后反应达到平衡,容器内C2H4为1.4 mol,CO2为0. 2 mol,则C2H6的平衡总转化率为% (保留三位有效数字)。
-
11. 某些过渡金属(如钛、铜)及其化合物,以其高导电性和丰富的物理化学性质在材料领域大放异彩。(1)、钛比钢轻、比铝硬。基态钛原子的价层电子排布式为:钛原子核外电子占据的轨道数。(2)、铜的下列状态中,失去最外层一个电子所需能量最小的是____。A、[Ar]3d104p1 B、[Ar]3d10 C、[Ar]3d94s1 D、[Ar]3d104s1(3)、二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的转化为 , 将甲基橙、亚甲基蓝、HCHO转化为CO2等。
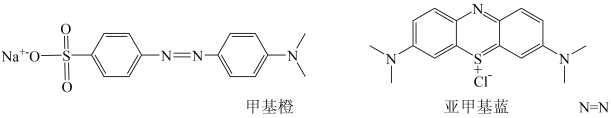
①的空间构型是。
②甲基橙、亚甲基蓝中C原子的杂化类型有 ,
③常温下,CO2、HCHO在水中溶解度之比大约是1:500,其主要原因是。
(4)、黄铜矿炼铜过程中会产生SO2 , 与SO2互为等电子体的分子和阴离子分别为(各写一种即可)。(5)、钙钛矿型太阳能电池近年越来越受到科学界的关注,其效率提升速度超越过去任何一类电池。某种钙钛矿晶胞如图所示,则钙原子的配位数是 , 若阿伏加德罗常数的值为NA , 晶胞中钙原子与氧原子的最近距离为a pm。则该晶胞的密度为g/cm3.(列出计算式)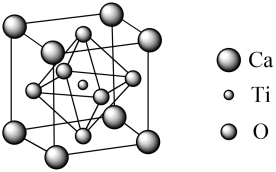
-
12. 苯的同系物A可以按如下途径合成一种食品保鲜剂F。

已知:RCHO + CH3CHORCH( OH ) CH2CHO
回答下列问题:
(1)、A的化学名称是 , D→E的反应类型为。(2)、C→D的化学方程式为 。(3)、E的结构简式是。(4)、检验F中的碳碳双键的方法是 。(5)、E的同分异构体中,满足下列条件的有。(a)苯环上有2个取代基;
(b)能发生银镜反应;
(c)能与FeCl3发生显色反应。
其中核磁共振a谱有5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式为。
(6)、写出以乙醇为原料制备1,3-丁二醇的合成路线(其他无机试剂任选)。
