广东省广州市2023届高三一模考试化学试题
试卷更新日期:2023-03-29 类型:高考模拟
一、单选题
-
1. 文物记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是
文物




选项
A.圆雕玉舞人
B.透雕重环玉佩
C.朱雀青铜顶饰
D.炫纹贯耳瓷壶
A、A B、B C、C D、D2. 中国空间站建造成功、神舟系列飞船顺利往返,均展示了我国科技发展的巨大成就。下列相关叙述正确的是A、空间站太阳翼伸展关键部件采用碳化硅材料,属于无机非金属材料 B、核心舱太阳能电池采用砷化镓()材料,属于金属材料 C、飞船火箭使用偏二甲肼作燃料,属于烃类 D、飞船返回舱使用氮化硅耐高温结构材料,属于分子晶体3. 实验室用和浓盐酸反应制备并回收 , 下列装置能达到实验目的的是( ) A、用①收集 B、用②吸收尾气 C、用③分离和溶液 D、用④蒸干溶液制4. 四氯化锗()是光导纤维的常用掺杂剂,锗与硅同族。下列说法错误的是A、基态原子价层电子排布式为 B、的熔点比低 C、的空间构型为正四面体 D、第一电离能大小:5. 以熔融盐(、)为电解液,以石墨为阳极,电解和获取电池材料 , 下列说法正确的是A、阳极上被还原 B、阴极发生的反应为 C、电解时,阳离子向阳极移动 D、理论上每生成电路中转移电子6. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是
A、用①收集 B、用②吸收尾气 C、用③分离和溶液 D、用④蒸干溶液制4. 四氯化锗()是光导纤维的常用掺杂剂,锗与硅同族。下列说法错误的是A、基态原子价层电子排布式为 B、的熔点比低 C、的空间构型为正四面体 D、第一电离能大小:5. 以熔融盐(、)为电解液,以石墨为阳极,电解和获取电池材料 , 下列说法正确的是A、阳极上被还原 B、阴极发生的反应为 C、电解时,阳离子向阳极移动 D、理论上每生成电路中转移电子6. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是选项
劳动项目
化学知识
A
工人用明矾处理废水
是两性氢氧化物
B
工人用消毒自来水
具有强氧化性
C
雕刻师用氢氟酸刻蚀石英制作艺术品
可与反应
D
酿酒师在葡萄酒中添加适量的二氧化硫
可以杀菌和抗氧化
A、A B、B C、C D、D7. 苯胺()是一种有机弱碱,可与盐酸反应生成盐酸盐()。下列叙述正确的是A、中碳原子的杂化轨道类型为 B、水溶液加水稀释,降低 C、水溶液中: D、在水中的电离方程式为:8. 将铜丝插入浓硝酸中进行如图所示的实验,下列说法正确的是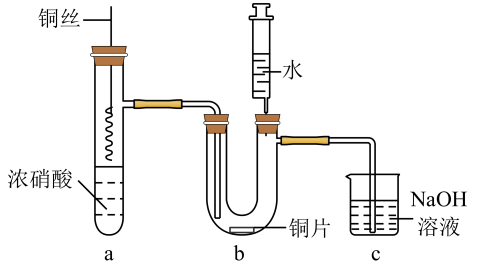 A、装置a中出现红棕色气体,只体现的酸性 B、一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅 C、注入水后装置b中铜片表面产生气泡,说明与硝酸生成 D、装置c用吸收尾气,说明和均是酸性氧化物9. 2022年我国科学家首次在月球上发现一种硅酸盐矿物,该物质含有X、Y、Z、W、E五种主族元素,原子序数依次增大且均不大于20,X、W为非金属元素,Y、Z、E为金属元素,Y的最高正化合价为 , Z和E同族。下列说法错误的是A、原子半径: B、X和Y可形成含有非极性键的离子化合物 C、Y、Z、E的最高价氧化物对应的水化物均为强碱 D、简单气态氢化物稳定性:10. 载人航天器中的物质和能量资源都十分宝贵,我国科学家进行了如图所示的氧循环研究,实现了空间站中氧气的再生。下列说法错误的是
A、装置a中出现红棕色气体,只体现的酸性 B、一段时间后抽出铜丝,向装置b注入水,b中气体红棕色变浅 C、注入水后装置b中铜片表面产生气泡,说明与硝酸生成 D、装置c用吸收尾气,说明和均是酸性氧化物9. 2022年我国科学家首次在月球上发现一种硅酸盐矿物,该物质含有X、Y、Z、W、E五种主族元素,原子序数依次增大且均不大于20,X、W为非金属元素,Y、Z、E为金属元素,Y的最高正化合价为 , Z和E同族。下列说法错误的是A、原子半径: B、X和Y可形成含有非极性键的离子化合物 C、Y、Z、E的最高价氧化物对应的水化物均为强碱 D、简单气态氢化物稳定性:10. 载人航天器中的物质和能量资源都十分宝贵,我国科学家进行了如图所示的氧循环研究,实现了空间站中氧气的再生。下列说法错误的是 A、用于循环的氢原子利用率为100% B、太阳能可作为反应①和②的能量来源 C、反应①为 D、等物质的量的和含有的电子数相同11. 下列物质性质实验对应的离子方程式书写正确的是A、铁与稀硫酸反应: B、溶液中通入硫化氢: C、通入酸性溶液中: D、溶液中加入稀硫酸:12. 在催化下醇的氧化氰化反应如图所示。下列叙述正确的是
A、用于循环的氢原子利用率为100% B、太阳能可作为反应①和②的能量来源 C、反应①为 D、等物质的量的和含有的电子数相同11. 下列物质性质实验对应的离子方程式书写正确的是A、铁与稀硫酸反应: B、溶液中通入硫化氢: C、通入酸性溶液中: D、溶液中加入稀硫酸:12. 在催化下醇的氧化氰化反应如图所示。下列叙述正确的是 A、熔点: B、键角: C、I和II分子中键数目相同 D、II含有的元素中的电负性最大13. 恒容密闭容器中,以硫()与为原料制备 , 受热分解成气态 , 发生反应 。的平衡转化率、的体积分数随温度的变化曲线如图所示。下列说法正确的是
A、熔点: B、键角: C、I和II分子中键数目相同 D、II含有的元素中的电负性最大13. 恒容密闭容器中,以硫()与为原料制备 , 受热分解成气态 , 发生反应 。的平衡转化率、的体积分数随温度的变化曲线如图所示。下列说法正确的是 A、 B、温度升高,分解率增大,体积分数增大 C、向平衡体系中充入惰性气体,平衡向右移动 D、其他条件相同,体积分数越大,平衡转化率越小14. 下列实验对应的现象和结论都正确的是
A、 B、温度升高,分解率增大,体积分数增大 C、向平衡体系中充入惰性气体,平衡向右移动 D、其他条件相同,体积分数越大,平衡转化率越小14. 下列实验对应的现象和结论都正确的是选项
实验
现象
结论
A
向食品脱氧剂样品(含还原铁粉)中加入硫酸后滴加酸性溶液
紫红色褪去
食品脱氧剂样品中含
B
向溶液中滴入溶液,再滴加溶液
加入后溶液变成血红色
既有氧化性又有还原性
C
向溶液加入铜片
溶液变蓝、有黑色固体出现
金属铁比铜活泼
D
向溶液中加入溶液后滴加几滴淀粉溶液
溶液变为蓝色
氧化性:
A、A B、B C、C D、D15. 新型Li-Mg双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图所示。放电时电极a的反应为:;下列说法错误的是 A、充电时,极为阴极 B、放电时,从I室向II室迁移 C、放电时,II室溶液的浓度增大 D、每消耗 , 电极a质量理论上增加16. 以酚酞为指示剂,用溶液滴定一元酸的溶液。溶液中,、分布系数( , 比如的分布系数:)随的变化关系如图所示,下列叙述错误的是
A、充电时,极为阴极 B、放电时,从I室向II室迁移 C、放电时,II室溶液的浓度增大 D、每消耗 , 电极a质量理论上增加16. 以酚酞为指示剂,用溶液滴定一元酸的溶液。溶液中,、分布系数( , 比如的分布系数:)随的变化关系如图所示,下列叙述错误的是 A、曲线①代表 , 曲线②代表 B、的数量级为 C、滴定过程中,溶液中不断减小 D、滴定终点时,
A、曲线①代表 , 曲线②代表 B、的数量级为 C、滴定过程中,溶液中不断减小 D、滴定终点时,二、非选择题
-
17. 醋酸钠是一种常用的防腐剂和缓冲剂。(1)、配制溶液,需要称量醋酸钠晶体( , )的质量为。实验需要的仪器有天平、药匙、玻璃棒、量筒、(从下列图中选择,写出名称)。
 (2)、某小组探究外界因素对水解程度的影响。
(2)、某小组探究外界因素对水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为):
i.实验和(填序号),探究加水稀释对水解程度的影响;
ii.实验1和3,探究加入对水解程度的影响;
iii.实验1和4,探究温度对水解程度的影响。
序号
温度
1
25℃
40.0
0
0
2
25℃
4.0
0
36.0
3
25℃
20.0
10.0
4
40℃
40.0
0
0
①根据甲同学的实验方案,补充数据:。
②实验测得 , 该结果不足以证明加入促进了的水解。根据(填一种微粒的化学式)的浓度增大可以说明加入能促进的水解。
③已知水解为吸热反应,甲同学预测 , 但实验结果为。实验结果与预测不一致的原因是。
(3)、小组通过测定不同温度下的水解常数确定温度对水解程度的影响。查阅资料: , 为溶液起始浓度。
试剂:溶液、盐酸、计。
实验:测定40℃下水解常数 , 完成下表中序号7的实验。
序号
实验
记录的数据
5
取溶液,用盐酸滴定至终点
消耗盐酸体积为
6
测40℃纯水的
7
在50℃和60℃下重复上述实验。
数据处理:40℃,(用含、、的计算式表示)
实验结论: , 温度升高,促进水解。
18. 铋的化合物在电催化和光催化领域都有广泛应用。一种从含铋矿渣(主要成分是、、、、等)中提取高纯的工艺如下: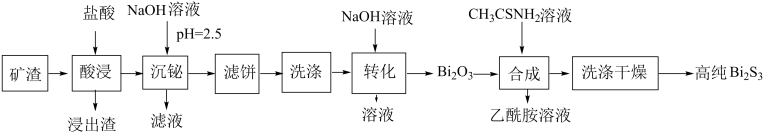
已知:
①乙酰胺()有臭味、有毒,熔点为82.3℃,沸点为221℃,可溶于水。
②常温下, , 。
③该工艺条件下,相关金属离子形成氢氧化物沉淀的范围如下:
离子
开始沉淀的
1.5
3.6
4.5
沉淀完全的
3.2
4.7
6.7
回答下列问题:
(1)、中的的化合价为 , 则的化合价是。(2)、“沉铋”时加入溶液,转化为沉淀的离子方程式是。往“沉铋”所得滤液中加入铁粉可回收其中的(填化学式)金属。(3)、“洗涤”时先用水洗,再用稀硫酸洗涤。用稀硫酸洗涤的目的是为了除去滤饼中的(填化学式)杂质。(4)、“转化”分两步进行:第一步转化为 , 反应的离子方程式为;第二步受热分解,。常温下,当恰好完全转化成时,溶液中浓度为 , 则此时溶液的为。(5)、“合成”所得乙酰胺的水溶液经。(填操作)可获得乙酰胺固体,以再生硫代乙酰胺()。(6)、钼酸铋()可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为 , , , 晶胞棱边夹角均为90°。①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知原子1的坐标为 , 则原子2的坐标为。
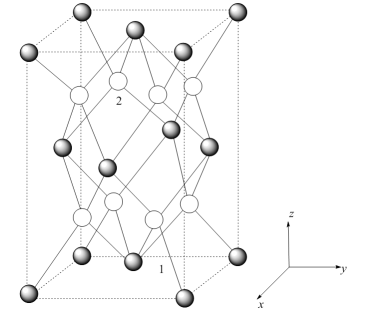
②设阿伏加德罗常数的值为 , 的式量为 , 则晶体的密度为 (列计算式)。
19. 乙醇可以通过部分氧化制氢气,涉及的相关反应方程式如下:a)
b)
c)
d)
(1)、若发生反应 , 可提高乙醇中氢原子的利用率,反应的(用代数式表示)。(2)、用平衡分压代替平衡浓度时,平衡常数可表示为 , 各反应的随温度的变化如图1所示。
①以上反应中,属于吸热反应的有(填字母)。
②平衡常数大于时可认为反应完全,则时,反应完全进行的有(填字母)。
(3)、恒压条件下往反应容器中通入和少量 , 平衡时体系中各物质(、、、、)的物质的量分数随温度的变化如图2所示。
①图中表示的曲线为。(填“”或“”)。
②下列说法正确的是(填编号)。
A.当气体密度不再发生变化时,反应达到平衡状态
B.温度升高,反应的增大,减小
C.达到平衡时分离出部分 , 反应c的平衡常数增大
D.加入稀有气体,重新达到平衡时的物质的量增加
③下达到平衡时和均反应完全,、和的物质的量分数分别为0.20、0.32、0.12,则平衡时的物质的量为 , 反应c的平衡常数K=。
20. 化合物VII是一种用于缓解肌肉痉挛的药物,其合成路线如下:
回答下列问题:
(1)、 中官能团的名称是。VI→VII的反应类型是。 (2)、中手性碳原子的个数是 (代表阿伏加德罗常数的值)。化合物
中官能团的名称是。VI→VII的反应类型是。 (2)、中手性碳原子的个数是 (代表阿伏加德罗常数的值)。化合物 的分子式是。 (3)、已知 (表示 , 则III的结构简式是。(4)、V→VI的化学方程式是。(5)、符合下列条件的化合物II的同分异构体有种。
的分子式是。 (3)、已知 (表示 , 则III的结构简式是。(4)、V→VI的化学方程式是。(5)、符合下列条件的化合物II的同分异构体有种。a.含有结构单元

b.含有
c.苯环上有两个取代基
(6)、参考上述信息,写出以苯甲醇和为原料制备 的合成路线。
的合成路线。