天津市十二区县重点学校2023年高三毕业班联考(一)考前模拟考化学
试卷更新日期:2023-03-27 类型:高考模拟
一、选择题(本大题共12小题,共36分)
-
1. 清洁燃料主要有两类,一类是压缩天然气 (CNG) ,另一类是液化石油气 (LPG) 。其主要成分都是( )A、碳氢化合物 B、碳水化合物 C、烃的衍生物 D、醇类2. 下列有关化学用语表示正确的是( )A、 的离子结构示意图:
 B、NH4H 的电子式:
B、NH4H 的电子式: C、水分子的比例模型:
C、水分子的比例模型: D、键线式
D、键线式 表示的有机物是 CH4
3. 下列“类比”合理的是( )A、常温下, Zn 和浓硫酸反应可以得到 SO2 ,则常温下 Al 和浓硫酸反应也可以得到 SO2 B、H2O 的沸点比H2S 的沸点高,则 CH4 的沸点比 SiH4 的沸点高 C、乙烯使溴水褪色发生加成反应,则乙烯使酸性高锰酸钾褪色也发生加成反应 D、加热条件下,和能直接化合生成 , 则加热条件下和也能直接化合生成4. 工业上以软锰矿主要成分为为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如下,下列说法错误的是( )
表示的有机物是 CH4
3. 下列“类比”合理的是( )A、常温下, Zn 和浓硫酸反应可以得到 SO2 ,则常温下 Al 和浓硫酸反应也可以得到 SO2 B、H2O 的沸点比H2S 的沸点高,则 CH4 的沸点比 SiH4 的沸点高 C、乙烯使溴水褪色发生加成反应,则乙烯使酸性高锰酸钾褪色也发生加成反应 D、加热条件下,和能直接化合生成 , 则加热条件下和也能直接化合生成4. 工业上以软锰矿主要成分为为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如下,下列说法错误的是( ) A、“熔融氧化”应在铁坩埚中进行 B、“锰酸钾歧化锰元素化合价既升高又降低”可以用代替 C、该流程中可循环使用的物质是 D、“滤液蒸发结晶”过程中加热蒸发至有较多晶体析出时停止加热5. 反应Ⅰ、Ⅱ、Ⅲ均会在工业生产硝酸过程中发生,其中反应Ⅰ、Ⅱ发生在氧化炉中,反应Ⅲ发生在氧化塔中,不同温度下各反应的化学平衡常数如表所示。下列说法正确的是( )
A、“熔融氧化”应在铁坩埚中进行 B、“锰酸钾歧化锰元素化合价既升高又降低”可以用代替 C、该流程中可循环使用的物质是 D、“滤液蒸发结晶”过程中加热蒸发至有较多晶体析出时停止加热5. 反应Ⅰ、Ⅱ、Ⅲ均会在工业生产硝酸过程中发生,其中反应Ⅰ、Ⅱ发生在氧化炉中,反应Ⅲ发生在氧化塔中,不同温度下各反应的化学平衡常数如表所示。下列说法正确的是( )温度
化学平衡常数
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
A、升高氧化炉的温度可提高反应Ⅰ的逆反应速率而减慢反应Ⅱ的逆反应速率 B、通过减小氧化炉的压强可促进反应而抑制反应Ⅱ C、在氧化炉中使用选择性催化反应的催化剂可增大氧化炉中的含量 D、氧化炉出气在进入氧化塔前应进一步提高温度6. 《本草纲目》中记载:“看药上长起长霜,则药已成矣。”其中“长霜”代表棓酸的结晶物,棓酸(只含C、H、O)的球棍模型如图所示。下列有关棓酸的说法错误的是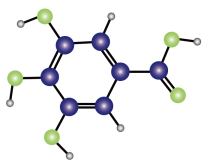 A、能发生加成反应和取代反应 B、能与溶液反应 C、分子式为 D、苯环上只有一种一氯代物7. 化学与生产、生活息息相关,下列说法正确的是A、75%的乙醇与84消毒液的消毒原理相同 B、钢铁在潮湿的空气中生锈主要发生电化学腐蚀 C、石油的分馏、裂化和煤的干馏都是化学变化 D、2022 年北京冬奥会比赛雪橇所使用的碳纤维材料属于有机高分子材料8. 维生素是重要的营养素,又称“抗坏血酸”,在人体内可发生如下转化:
A、能发生加成反应和取代反应 B、能与溶液反应 C、分子式为 D、苯环上只有一种一氯代物7. 化学与生产、生活息息相关,下列说法正确的是A、75%的乙醇与84消毒液的消毒原理相同 B、钢铁在潮湿的空气中生锈主要发生电化学腐蚀 C、石油的分馏、裂化和煤的干馏都是化学变化 D、2022 年北京冬奥会比赛雪橇所使用的碳纤维材料属于有机高分子材料8. 维生素是重要的营养素,又称“抗坏血酸”,在人体内可发生如下转化:
下列有关维生素的说法不正确的是( )
A、含有羟基、酯基、碳碳双键三种官能团 B、在该转化过程中被氧化 C、碱性环境中更易被破坏 D、易溶于水,因此饮用鲜榨果汁比直接食用水果营养更好9. 下列对分子结构及其性质的解释中,不正确的是( )A、碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 B、乳酸属于手性分子,因分子中存在一个手性碳原子 C、配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道 D、酸性 , 是因为分子非羟基氧原子数目比多10. 锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。下列关于原电池和干电池的说法不正确的是 ( ) A、两者正极材料不同 B、的放电产物可能是 C、两者负极反应式均为失电子 D、原电池中与稀存在自放电现象11. 根据下列装置和物质,能达到相应实验目的的是( )
A、两者正极材料不同 B、的放电产物可能是 C、两者负极反应式均为失电子 D、原电池中与稀存在自放电现象11. 根据下列装置和物质,能达到相应实验目的的是( ) A、图:测定溶液浓度 B、图:检验乙醇消去反应的产物 C、图:利用牺牲阳极法来防止钢铁输水管的腐蚀 D、图:制备12. 海水是一个巨大的资源宝库,下图是从海水中提取镁的流程图。
A、图:测定溶液浓度 B、图:检验乙醇消去反应的产物 C、图:利用牺牲阳极法来防止钢铁输水管的腐蚀 D、图:制备12. 海水是一个巨大的资源宝库,下图是从海水中提取镁的流程图。
以下说法错误的是( )
A、反应中,氧化还原反应有个 B、电解槽中的反应在常温下即可发生,节约能源 C、使用贝壳为原料制备 , 可降低生产成本 D、实验室模拟浓缩池中的过程,需要在气氛中蒸发浓缩二、简答题(本大题共4小题,共64分)
-
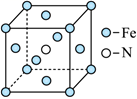
13. 的合成及应用一直是科学研究的重要课题。(1)、以、合成 , 是常用的催化剂。基态原子简化电子排布式为 。(2)、铁单质和氨气在可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为 。
 (3)、我国化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
(3)、我国化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。分解得。的空间结构为 。
体积水可溶解体积 , 体积水可溶解约体积。极易溶于水的原因是 。
反应时,向饱和溶液中先通入的气体是 。
(4)、NH3、氨棚烷的储氢量高,是具有广泛应用前景的储氢材料。存在配位键,提供孤电子对的原子是 。
比较沸点: 填“”或“”。
14. 克霉唑为广谱抗真菌药,对多种真菌尤其是白色念珠菌具有较好的抗菌作用,其合成路线如图:
已知:甲苯与氯气在三氯化铁催化下得到两种物质:
 和
和 回答下列问题:(1)、E的名称是;中的官能团名称为。(2)、合成克霉唑的过程中,发生最多的反应类型是。(3)、在由制取的过程中,不是由一步反应生成 , 其原因为。(4)、写出的化学方程式。(5)、M与互为同分异构体,满足下列两个条件的有种不包括本身。
回答下列问题:(1)、E的名称是;中的官能团名称为。(2)、合成克霉唑的过程中,发生最多的反应类型是。(3)、在由制取的过程中,不是由一步反应生成 , 其原因为。(4)、写出的化学方程式。(5)、M与互为同分异构体,满足下列两个条件的有种不包括本身。含有三个苯环
苯环之间不直接相连写出其中核磁共振氢谱有组峰,且峰面积比为::::的结构简式。
(6)、结合题中信息,写出用苯为原料,制备 的合成路线无机试剂任选。 15. 铁是一种非常重要的金属。(1)、中科院兰州化学物理研究所用催化加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂、、也起催化作用后可改变反应的选择性。
的合成路线无机试剂任选。 15. 铁是一种非常重要的金属。(1)、中科院兰州化学物理研究所用催化加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂、、也起催化作用后可改变反应的选择性。
①下列说法正确的是 。填序号
A.第Ⅰ步反应的活化能低于第Ⅱ步
B.第Ⅰ步所发生的反应为:
C.使加氢合成低碳烯烃的减小
D.保持其他条件不变,添加不同助剂后各反应的平衡常数不变
加入助剂能提高单位时间内乙烯产量的根本原因是 。
(2)、复合氧化物铁酸锰可用于热化学循环分解制氢气,原理如下:则与、的关系表达式为 。
(3)、纳米铁是重要的储氢材料,可用反应制得。在恒容密闭容器中加入足量铁粉和 , 在、不同温度下进行反应,测得与温度、时间的关系如图所示。, 填“”或“”。

温度下,平衡时体系的总压强为。用某气体组分的平衡分压分压总压物质的量分数代替物质的量浓度也可表示平衡常数记作 , 则用表示。
(4)、高铁酸钾被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。电解法可制得 , 装置如图 , 阳极电极反应式为: , 若转移电子,则透过交换膜的离子数目为 。
 16. 废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍.湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品.某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
16. 废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍.湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品.某化学小组模拟该方法回收铜和制取胆矾,流程简图如下: (1)、反应Ⅰ是将转化为 , 反应中的作用是操作的名称: .(2)、反应Ⅱ是铜氨溶液中的与有机物反应,写出该反应的离子方程式:操作用到的主要仪器名称为 , 其目的是填序号 .
(1)、反应Ⅰ是将转化为 , 反应中的作用是操作的名称: .(2)、反应Ⅱ是铜氨溶液中的与有机物反应,写出该反应的离子方程式:操作用到的主要仪器名称为 , 其目的是填序号 .富集铜元素 使铜元素与水溶液中的物质分离 增加在水中的溶解度
(3)、反应Ⅲ是有机溶液中的与稀硫酸反应生成和若操作使用图2装置,图中存在的错误是 .(4)、操作以石墨作电极电解溶液.阴极析出铜,阳极产物是操作由硫酸铜溶液制胆矾的主要步骤是 .(5)、流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 .循环使用的在反应Ⅰ中的主要作用是 .