山东省济南市历下区2023年区域3月联考化学试题
试卷更新日期:2023-03-24 类型:中考模拟
一、单选题
-
1. 物质世界是不断运动和变化的。下列各变化过程中,只发生了物理变化的是( )A、铁锅生锈 B、葡萄酿酒 C、瓷器破碎 D、木炭燃烧2. 绿水青山就是金山银山,保护绿水青山,是我们每个公民的责任。下列做法中,不利于环境保护的是( )A、节约用纸,绿色出行 B、节约用水,保泉护泉 C、垃圾分类,再生利用 D、燃放烟花,焚烧落叶3. 快节奏的生活方式让很多人喜欢在互联网上购买外卖食品。下列外卖食品的派送、食材保存、制作方式符合科学绿色原理的是( )A、为了使海鲜更加鲜美,适量使用甲醛浸泡 B、食物荤素合理搭配,保证各种营养的均衡摄入 C、为延长食品保质期,在食品中添加过量的防腐剂 D、大量使用一次性塑料餐盒和塑料袋派送食品4. 下列图示实验操作中,正确的是( )A、
 检查装置气密性
B、
检查装置气密性
B、 向试管中加固体
C、
向试管中加固体
C、 加热液体
D、
加热液体
D、 过滤
5. “中国高铁”已成为我国外交的新名片,高铁车身主要采用镍铬奥氏体不锈钢制成。下图为铬元素在元素周期表中的信息及原子结构示意图。下列说法错误的是( )
过滤
5. “中国高铁”已成为我国外交的新名片,高铁车身主要采用镍铬奥氏体不锈钢制成。下图为铬元素在元素周期表中的信息及原子结构示意图。下列说法错误的是( ) A、铬元素属于金属元素 B、铬元素的原子序数为 24 C、铬元素在化合物中通常显−1 价 D、铬的相对原子质量是 52.006. 下列有关化学学科观念的说法中,不合理的是( )A、能量观:化学变化的过程也会伴随能量的变化 B、守恒观:镁条在空气中燃烧,反应前后固体的质量相等 C、变化观:一氧化碳与二氧化碳在一定条件下可相互转化 D、微粒观:酸溶液中都含有氢离子,所以酸具有通性7. 人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示,其中,酸性最强的是()
A、铬元素属于金属元素 B、铬元素的原子序数为 24 C、铬元素在化合物中通常显−1 价 D、铬的相对原子质量是 52.006. 下列有关化学学科观念的说法中,不合理的是( )A、能量观:化学变化的过程也会伴随能量的变化 B、守恒观:镁条在空气中燃烧,反应前后固体的质量相等 C、变化观:一氧化碳与二氧化碳在一定条件下可相互转化 D、微粒观:酸溶液中都含有氢离子,所以酸具有通性7. 人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示,其中,酸性最强的是()体液名称
胃液
血液
唾液
胆汁
pH
0.9﹣1.5
7.35﹣7.45
6.6﹣7.1
7.1﹣7.3
A、胃液 B、血液 C、唾液 D、胆汁8. 宏观辨识与微观探析相结合是化学特有的思维方式。下表对应内容中,错误的是( )选项
宏观事实
微观解释
A
“二手烟”也会危害身体健康
分子在不断地运动
B
氧气和液氧化学性质相同
同种分子性质相同
C
水在直流电作用下生成氢气和氧气
化学变化中分子和原子种类改变
D
木炭在氧气中比在空气中燃烧更剧烈
碳原子在等体积空间内接触碰撞的氧分子数目不同
A、A B、B C、C D、D9. 学习科学知识可以用来辨别“真”、“伪”。下列叙述中,属于“真”的是( )A、活性炭具有吸附性,可使硬水软化 B、如果不加入催化剂,过氧化氢就不会分解 C、氮气的化学性质较稳定,可用作粮食瓜果保护气 D、自然界中“水循环”“氧循环”“碳循环”都是通过物理变化实现的10. 探究物质性质过程中往往伴随着丰富的实验现象。下列有关实验现象的描述中,错误的是( )A、硝酸铵固体溶于水吸收热量,使溶液温度升高 B、将镁条放入稀硫酸中,镁条逐渐减少,有大量气体产生 C、将铜片在空气中加热,红色铜片表面逐渐变黑 D、灼烧羊毛制品,会产生烧焦羽毛气味二、多选题
-
11. 构建分子、原子模型,通过微观模拟示意图来描述反应过程是化学学科核心素养的一部分。下图是某微观模拟示意图,下列有关该反应的说法中,错误的是( )
 A、图示中 x 的值为 2 B、反应前后氮元素的化合价没有发生改变 C、该反应属于氧化反应 D、参加反应的甲、乙两物质的质量比为 4﹕312. 将某失去标签的无色溶液 X 取三等份,分别向其中加入 CuCl2溶液、MgCl2溶液、NH4Cl 溶液,产生的现象如下表所述。根据现象判断,无色溶液 X 可能是( )
A、图示中 x 的值为 2 B、反应前后氮元素的化合价没有发生改变 C、该反应属于氧化反应 D、参加反应的甲、乙两物质的质量比为 4﹕312. 将某失去标签的无色溶液 X 取三等份,分别向其中加入 CuCl2溶液、MgCl2溶液、NH4Cl 溶液,产生的现象如下表所述。根据现象判断,无色溶液 X 可能是( )加入的物质
CuCl2溶液
MgCl2溶液
NH4Cl 溶液
实验现象
出现蓝色沉淀
出现白色沉淀
产生刺激性气味气体
A、稀硫酸 B、石灰水 C、NaCl 溶液 D、Ba(OH)2溶液13. 下列实验方案中,能达到相应实验目的是( )选项
实验目的
实验方案
A
鉴别Na2SO4、BaSO4两种白色粉末
加水溶解,观察现象
B
除去CO中的CO2
将混合气体依次通过足量NaOH溶液、浓硫酸
C
制备Cu(OH)2
向氧化铜中加入足量NaOH溶液,过滤
D
比较铁和铜的金属活动性强弱
铁丝、铜丝分别放入稀硫酸中,观察现象
A、A B、B C、C D、D14. 室温下,将质量为 ag 的铁粉加到 bgH2SO4和 CuSO4的混合溶液中充分反应。则下列有关说法中,不合理的是( )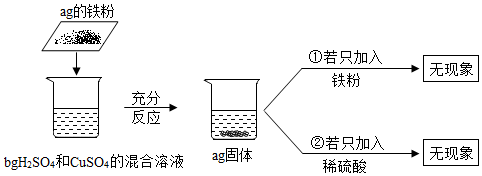 A、反应后固体只含有 Cu B、反应后溶液质量仍为 bg C、反应后溶液中阳离子只含 Fe3+ D、若向反应后溶液中加入 NaOH,会有蓝色沉淀产生15. 取一定质量的碳酸钙固体高温灼烧一定时间,测得反应后剩余固体质量为8.8g,其中钙元素质量分数为50%,则下列说法中符合事实的是( )A、碳酸钙固体高温灼烧发生了氧化反应 B、反应前碳酸钙固体的质量为11g C、生成CO2气体的质量为2.2g D、反应后剩余固体中氧化钙质量为5.6g
A、反应后固体只含有 Cu B、反应后溶液质量仍为 bg C、反应后溶液中阳离子只含 Fe3+ D、若向反应后溶液中加入 NaOH,会有蓝色沉淀产生15. 取一定质量的碳酸钙固体高温灼烧一定时间,测得反应后剩余固体质量为8.8g,其中钙元素质量分数为50%,则下列说法中符合事实的是( )A、碳酸钙固体高温灼烧发生了氧化反应 B、反应前碳酸钙固体的质量为11g C、生成CO2气体的质量为2.2g D、反应后剩余固体中氧化钙质量为5.6g三、填空题
-
16. 请回答下列问题。(1)、按要求从氢氧化钙、碳酸钡、镁、二氧化硫中选取合适的物质,将其化学式填写在下列横线上。
①一种可燃烧的金属单质;
②一种难溶于水的盐;
③用于改良酸性土壤的碱;
④导致酸雨的氧化物。
(2)、“人不负青山,青山定不负人。”坚持绿色发展,保护生态环境,已成为全社会共识。试回答下列问题:①我市是全国文明城市,作为市民更应该养成生活垃圾分类投放的良好习惯。废弃塑料瓶、书、报纸应投入印有下列哪种标识的垃圾箱。
A.
 B.
B. C.
C. D.
D.
②为响应“限塑令”,济南各大型超市全部更换成可降解塑料袋,其中一种可降解塑料袋的主要成分是聚乙烯醇,分子式为(C2H4O)n,聚乙烯醇属于(选填“有机物”、“无机物”、“氧化物”之一);在该物质中碳、氧两种元素的质量比为(填最简整数比),质量分数最小的元素是(填元素符号)。
③发电厂采用“石灰固硫法”来减少二氧化硫的排放,方法之一是向煤中掺入一定量的生石灰,使其与二氧化硫在高温条件下化合生成一种固体。已知这一过程中,各元素化合价均未发生变化,请写出 该“石灰固硫法”的化学方程式:。

四、综合题
-
17. 海洋是个巨大的资源宝库。海水淡化、海水晒盐等对海洋资源的充分利用,体现了人类认识物质、改造物质的智慧。(1)、采用如图所示的膜分离法淡化海水,水分子可以通过淡化膜进入左侧的淡水池,从而得到淡水。下列说法中,不合理的是____(填选项序号之一)。
 A、膜分离法也是一种分离混合物的方法 B、膜分离法较传统蒸馏法更节约能源 C、加压后右侧海水中溶质质量分数增大 D、加压后右侧海水的溶质质量增多(2)、采用盐田法晒盐,经日晒、风吹等,结晶池中会有氯化钠晶体析出,此时结晶池中的溶液为氯化钠的 (填“饱和”或“不饱和”之一)溶液。该过程主要通过(选填“降温结晶”或 “蒸发结晶”之一)使食盐析出。(3)、下图是粗盐在工业生产中的一种应用流程,请根据信息回答问题:
A、膜分离法也是一种分离混合物的方法 B、膜分离法较传统蒸馏法更节约能源 C、加压后右侧海水中溶质质量分数增大 D、加压后右侧海水的溶质质量增多(2)、采用盐田法晒盐,经日晒、风吹等,结晶池中会有氯化钠晶体析出,此时结晶池中的溶液为氯化钠的 (填“饱和”或“不饱和”之一)溶液。该过程主要通过(选填“降温结晶”或 “蒸发结晶”之一)使食盐析出。(3)、下图是粗盐在工业生产中的一种应用流程,请根据信息回答问题:
①步骤I中若使 NaCl 不饱和溶液转变成饱和溶液,合理的方法是(填选项序号)。
A.蒸发溶剂 B.增加溶质 C.升高温度
②步骤II中用烧碱低温制取次氯酸钠的反应原理为:Cl2+2NaOH=X+NaClO+H2O,则X的化学式是 , NaClO 中氯元素的化合价为。
③步骤III是“侯氏制碱法”的重要步骤,写出其反应的化学方程式:。
(4)、海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素,NaCl 和 KNO3的溶解度曲线如图所示,试回答下列问题:
①在t2℃时,KNO3的溶解度NaCl的溶解度(选填“大于”、“等于”或“小于”之一)。
②在t1℃时,50g 水中最多能溶解g KNO3。
③图中P点所表示的是对应温度下 KNO3的(选填“饱和”或“不饱和”之一)溶液。
④将t2℃时 KNO3饱和溶液降温到 t1℃,溶液中 KNO3 的质量分数会(选填“变大”“变小”或“不变”之一)。
18. 下图所示为实验室中常见气体制备、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学利用其进行下列化学实验。 (1)、第一组同学以石灰石和稀盐酸为原料,制取、收集一瓶纯净、干燥的二氧化碳气体。(盐酸会挥发出少量的氯化氢气体,导致制取的气体不纯,可用饱和碳酸氢钠溶液吸收)
(1)、第一组同学以石灰石和稀盐酸为原料,制取、收集一瓶纯净、干燥的二氧化碳气体。(盐酸会挥发出少量的氯化氢气体,导致制取的气体不纯,可用饱和碳酸氢钠溶液吸收)①所选仪器的连接顺序为 (填写仪器序号字母)。
②生成二氧化碳时,所发生反应的化学方程式为。
③实验室制取二氧化碳后的剩余废液中常含有少量盐酸,若在不用酸碱指示剂的条件下,加入某种药品除去其中的盐酸,得到较纯净的中性液体,请从纯碱、熟石灰、石灰石三种物质中选用一种合适的试剂是 , 并简述实验过程。
(2)、第二组的同学查阅资料后得知,现在很多饮料瓶是由 PET(聚对苯二甲酸乙二醇酯)塑料制成的,现有一种 PET 塑料样品(已知:该塑料样品只含 C、H、O 三种元素),该小组的同学欲以过氧化氢溶液为原料(MnO2 为催化剂)制备氧气,并对该塑料的组成元素进行定量分析探究。实验前检验装置气密性。使该塑料样品在纯氧气中完全燃烧,所选仪器按“A → B1 → E → B2 → C →碱石灰干燥管”的顺序连接,(B1 , B2为浓硫酸洗气瓶),试回答下列问题:(假设所有发生的化学反应都完全进行)①仪器 A 中所发生反应的化学方程式为:。
②装置B1的作用是。
③实验测得仪器 E 的玻璃管中放入的塑料试样质量为wg,塑料试样充分燃烧后,测得仪器B1质量增加ag,测得仪器B2质量增重bg,仪器C质量增重ng,则该塑料试样中含氢元素的质量为g(计算结果用代数式表示,可为分数形式)。
19. 请回答下列问题。(1)、药品使用或保存不当,试剂瓶上的标签常常易损毁。小琪同学在实验室发现一瓶标签损毁的无色溶液(标签如图所示)。老师告诉她,该瓶溶液可能是稀硫酸、Na2SO4溶液、CuSO4溶液、Na2CO3 溶液中的一种。小琪决定对这瓶液体进行实验探究。
【信息分析】结合上述信息分析,该瓶液体一定不是溶液。
【收集证据】为了继续确定该瓶溶液的成分,小琪进行如下实验:
实验步骤
现象
结论
①取该溶液少量于试管中,向其中加入少许铁粉
无明显现象
该溶液不是
②取少量该溶液于试管中,滴加适量Ba(NO3)2 溶液,振荡
该溶液是 Na2SO4溶液
③过滤,向滤渣中滴加过量的稀硝酸
根据所学知识,试写出实验步骤②中发生反应的化学方程式:。
(2)、已知固体混合物 A 可能是 NaCl 和 CaCO3或两者之一;另有一固体混合物 B,其中可能含有 NH4Cl、CuO、CuCl2三种物质中的一种或多种。按如图所示进行探究实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。
试根据实验过程和发生的现象做出判断,填写以下空白:
①气体 G 溶于水,滴入无色酚酞试液,溶液变色。
②请写出蓝色沉淀 F 的化学式。
③混合物 B 中一定含有的物质是 (填化学式)
④无色溶液 H 中,一定大量存在的金属阳离子是 (填离子符号)。
⑤写出 1 个生成白色沉淀 I 的化学方程式。
20. 请回答下列问题。(1)、人类文明与金属材料的发展应用关系十分密切。
①三星堆遗址的重大考古发现,向世界展示了中华传统文化所蕴含的丰富宝藏和巨大魅力。三星堆遗址现已出土了青铜面具、青铜神树、象牙等重要文物。青铜属于(选填“合金”“氧化物”“化合物”之一)。
②西汉刘安所著《淮南万毕术》中有关于“曾青得铁则化为铜”的记载,湿法炼铜这类化学反应属于反应。(选填“分解”“化合”“置换”“复分解”之一)
③近现代,钢铁工业的发展状况是世界各国工业化水平的重要标志之一,利用一氧化碳和氧化铁在高温条件下发生反应,是目前工业炼铁的主要原理,请你写出该反应的化学方程式:。
(2)、为测定某赤铁矿石中所含氧化铁的质量分数,实验小组的同学称取 10.0g 赤铁矿石样品倒入烧杯中,然后向其中逐滴加入溶质质量分数为 10.95%的稀盐酸。加入稀盐酸的质量与反应后剩余固体的质量关系如下图所示(赤铁矿石中所含杂质不溶于水,也不与稀盐酸反应),试回答:
①当滴入稀盐酸 200g 时(即图中 B 点时),烧杯内溶液中的溶质是(填化学式)
②请读取图中信息,计算该赤铁矿石中含氧化铁的质量分数(写出计算过程,计算结果精确至 0.1%)
-