安徽省2023年中考名校大联考模拟化学试题
试卷更新日期:2023-03-24 类型:中考模拟
一、单选题
-
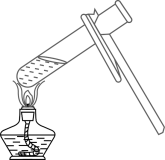
1. 2022年春季,教育部印发了《义务教育课程方案》,劳动课将正式成为中小学的一门独立课程。下列劳动实践.包含化学变化是( )A、挑水砍柴 B、生火做饭 C、打扫庭院 D、整理房间2. 中国共产党在二十大报告中指出“深入推进环境污染防治,持续深入打好蓝天、碧水、净土保卫战.",防治空气污染,保护生态环境。下列做法不合理的是( )A、开发使用清洁能源 B、大力植树造林、种花种草 C、掩埋废旧电池 D、管理和控制工地扬尘3. .列化学实验操作正确的是( )A、加热液体
 B、倾倒液体
B、倾倒液体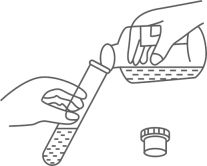 C、滴加液体
C、滴加液体 D、量取液体
D、量取液体 4. 安徽临泉是生姜生产基地,姜黄素是从生姜根茎中提取的一种二酮类化合物,具有良好的抗炎和抗癌特性,化学式为C21H20O6 , 下列对该物质的说法中正确的是( )A、姜黄素中氢元素的质量分数最大 B、姜黄素中碳元素与氧元素的质量比为12:16 C、姜黄素由47个原子构成 D、姜黄素由碳、氢、氧三种元素组成5. 微量元素锶可以补气益血、美容养颜、提高睡眠质量,如图是锶元素在元素周期表中显示的信息。下列说法正确的是( )
4. 安徽临泉是生姜生产基地,姜黄素是从生姜根茎中提取的一种二酮类化合物,具有良好的抗炎和抗癌特性,化学式为C21H20O6 , 下列对该物质的说法中正确的是( )A、姜黄素中氢元素的质量分数最大 B、姜黄素中碳元素与氧元素的质量比为12:16 C、姜黄素由47个原子构成 D、姜黄素由碳、氢、氧三种元素组成5. 微量元素锶可以补气益血、美容养颜、提高睡眠质量,如图是锶元素在元素周期表中显示的信息。下列说法正确的是( ) A、锶是一种非金属元素 B、锶原子的中子数为38 C、锶的元素符号是Sr D、锶的相对原子质量为87.62 g6. 下列有关实验现象的描述,正确的( )A、镁在空气中燃烧产生大量白雾 B、硝酸铵溶解于水时,溶液温度显著升高 C、高温下木炭与氧化铜共热后,试管里有红色物质生成 D、光亮的铜丝放入硝酸银溶液中,铜丝表面有银析出7. 建立模型是学习化学的重要方法。下列模型正确的是( )A、空气成分模型
A、锶是一种非金属元素 B、锶原子的中子数为38 C、锶的元素符号是Sr D、锶的相对原子质量为87.62 g6. 下列有关实验现象的描述,正确的( )A、镁在空气中燃烧产生大量白雾 B、硝酸铵溶解于水时,溶液温度显著升高 C、高温下木炭与氧化铜共热后,试管里有红色物质生成 D、光亮的铜丝放入硝酸银溶液中,铜丝表面有银析出7. 建立模型是学习化学的重要方法。下列模型正确的是( )A、空气成分模型 B、物质分类关系模型
C、原子结构模型
B、物质分类关系模型
C、原子结构模型 D、化学反应类型分类模型
8. 根据下列实验方案进行实验,能达到相应实验目的的是( )
D、化学反应类型分类模型
8. 根据下列实验方案进行实验,能达到相应实验目的的是( )编号
A
B
C
D
实验方案




实验目的
探究影响物质溶解性的因素
比较Zn和Fe的金属活动性强弱
探究铁钉生锈时氧气是否参与反应
探究蜡烛中是否含有氧元素
A、A B、B C、C D、D9. 逻辑推理是化学学习中常用的一种思维方法。以下推理正确的是( )A、燃烧是发光发热的化学反应,燃烧一定要有氧气参加 B、阳离子都带正电荷,则带正电荷的微粒一定是阳离子 C、碱中都含有氢、氧元素,则含有氢、氧元素的化合物都是碱 D、酸溶液能使紫色石蕊溶液变红,但能使紫色石蕊溶液变红的溶液不一定是酸溶液10. 工业上使用一种国产低温催化剂生产氢气的反应过程如图所示,下列说法错误的是( ) A、该反应前后分子、原子的种类一定不变 B、该反应前后一定有元素化合价发生改变 C、该反应有三种氧化物 D、参加反应的
A、该反应前后分子、原子的种类一定不变 B、该反应前后一定有元素化合价发生改变 C、该反应有三种氧化物 D、参加反应的 与
与 的质量比为9:14
11. 下列实验设计能达到实验目的的是( )
的质量比为9:14
11. 下列实验设计能达到实验目的的是( )选项
实验目的
实验设计
A
除去氮气中的少量氧气
通过灼热的氧化铜
B
鉴别二氧化锰和木炭粉
观察颜色
C
区分白酒和白醋
闻气味
D
从KCl和MnO2的混合物中回收MnO2
加水充分溶解、过滤、蒸发结晶
A、A B、B C、C D、D12. 如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线、结合图示判断,下列说法正确的是( )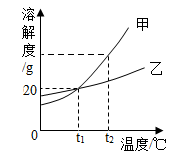 A、甲物质溶解度大于乙物质溶解度 B、t1℃时20 g乙物质投入水中一定能完全溶解 C、t1℃时,甲、乙溶液中溶质的质量分数一定相等 D、t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大
A、甲物质溶解度大于乙物质溶解度 B、t1℃时20 g乙物质投入水中一定能完全溶解 C、t1℃时,甲、乙溶液中溶质的质量分数一定相等 D、t2℃时相同质量的甲、乙饱和溶液,乙溶液中溶剂质量更大二、科普阅读题
-
13. 阅读下列短文,回答问题。
2022年11月,在埃及沙姆沙伊赫举行的第二十七届联合国气候变化大会(COP27)上,讨论的核心物质仍是CO2 , 如何降低大气中CO2浓度,是人类一直在研究的重要议题。气候变化是国际社会的一个重要挑战,对二氧化碳的综合利用也是国际研究的热点,如工业上可以将CO2转化成尿素、甲醇等资源;科学家还发现了一种镍与有机物组成的混合催化剂,利用太阳光能,可将水中溶解的CO2转化成CO和O2;我国科学家在实验室首次实现了利用CO2直接人工合成淀粉[ (C6H10O5)n],这是中国科学家在人工合成淀粉方面取得的颠覆性、原创性突破。
(1)、煤、天然气都属于不可再生能源,可以开发利用的新能源有(写一种即可)。(2)、科学家还发现了一种镍与有机物组成的混合催化剂,利用太阳光能,可将水中溶解的CO2转化成CO和O2 , 该过程用化学方程式表示为。(3)、推断淀粉在空气中完全燃烧的产物是(填物质名称)。(4)、“我国科学家利用二氧化碳直接人工合成淀粉”的意义:(写一条即可)。三、综合题
-
14. 根据下列装置图,回答问题:
 (1)、仪器a的名称是。(2)、实验室某小组选取A装置作为发生装置制取氧气,则反应的化学方程式为。(3)、若选取F装置,采用排空气法收集二氧化碳,气体应从端(填“m”或“n”)通入。检验气体收集满的方法是。(4)、B装置的分液漏斗可以控制化学反应速率,还可以用代替也能达到同样效果。15. 实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
(1)、仪器a的名称是。(2)、实验室某小组选取A装置作为发生装置制取氧气,则反应的化学方程式为。(3)、若选取F装置,采用排空气法收集二氧化碳,气体应从端(填“m”或“n”)通入。检验气体收集满的方法是。(4)、B装置的分液漏斗可以控制化学反应速率,还可以用代替也能达到同样效果。15. 实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下: (1)、将工业废渣粉碎成粉末再与(NH4)2CO3溶液浸取的目的是。(2)、过滤所需的仪器有铁架台、烧杯、漏斗和 , 其作用是。(3)、写出CaCO3高温煅烧的化学方程式。(4)、上述流程中涉及到的物质,属于金属氧化物的是(填物质名称)。16. 学习了常见的酸和碱以后,同学们用学过的酸碱知识对日常生活中的现象进行分析,下面是他们的项目式探究学习。
(1)、将工业废渣粉碎成粉末再与(NH4)2CO3溶液浸取的目的是。(2)、过滤所需的仪器有铁架台、烧杯、漏斗和 , 其作用是。(3)、写出CaCO3高温煅烧的化学方程式。(4)、上述流程中涉及到的物质,属于金属氧化物的是(填物质名称)。16. 学习了常见的酸和碱以后,同学们用学过的酸碱知识对日常生活中的现象进行分析,下面是他们的项目式探究学习。【探究一】2021年12月9日,我国“天宫课堂”第一课成功授课。兴趣小组同学对其中的“泡腾片实验”很好奇,于是开展如下探究。
【查阅资料】

①维生素C(C6H8O6)具有增强机体抵抗力,预防和治疗坏血病等作用。某品牌维生素C泡腾片主要成分如图二。
②柠檬酸为食用酸类,由碳、氢、氧三种元素组成,可增强体内正常代谢,适当剂量对人体无害。柠檬酸易溶于水,20℃时,其2%水溶液的pH为2.1。
【提出问题】维生素C泡腾片溶于水后产生的气体是什么?
(1)、【猜想与假设】【猜想一】CO
【猜想二】H2
【猜想三】N2
【猜想四】O2
【猜想五】CO2
①同学甲认为猜想一和猜想二不成立,不可能含有CO和H2 , 因为从药品安全角度考虑,H2易燃易爆,CO易燃易爆、有毒。
②同学乙认为猜想产生的气体也不可能含有N2 , 因为。
③同学丙认为该气体可能含有O2、CO2中的一种或两种。
(2)、【进行实验】实验编号
实验操作
实验现象
实验结论
Ⅰ
将一片维生素C泡腾片放入装有水的试管中
有大量气泡产生
——
Ⅱ
将带火星的木条伸入试管
带火星的木条没有复燃
该气体中不含O2
Ⅲ
将气体通入澄清石灰水中
澄清石灰水变浑浊
该气体中含有
(3)、【解释与结论】①同学丁认为带火星的木条没有复燃,不能确定该气体中不含O2 , 理由是。
②图二主要成分碳酸氢钠在医疗上是治疗胃酸过多的药剂之一,写出该反应的化学方程式。
(4)、【反思与评价】联系生活常识,说说保存药品的注意事项是。(写一条即可)(5)、【探究二】同学们发现实验III向饱和澄清石灰水中通入二氧化碳,结果发现开始澄清石灰水变浑浊,继续通气,发现变浑浊的石灰水又变澄清,同学们对此又展开探究。同学们取2 mL饱和澄清石灰水于试管中,用4 mL蒸馏水稀释,向其中缓慢通入足量CO2。测定反应过程中的电导率变化如图三所示。(忽略反应前后溶液体积的变化)
【查阅资料】
材料一:实验中通常用电导率来表示溶液传导电流的能力;溶液的导电力越强,溶液的电导率越大。
材料二:单位体积溶液中某离子的个数越多,则该离子的浓度越大,溶液的导电能力越强。相同浓度的不同离子导电能力不同。
材料三:Ca(OH)2溶于水能完全解离出Ca2+和OH-。
①CaCO3遇到溶有CO2的水时,能反应生成易溶于水的Ca(HCO3)2 , Ca(HCO3)2在水中能完全解离出Ca2+和。
②石灰水中通入CO2气体,溶液的电导率开始逐渐降低的主要原因是。
③反应最终电导率的稳定值低于初始值的可能原因是、。
四、计算题
-
17. 某小组同学取过氧化氢溶液与二氧化锰的混合物155.5 g,反应后分别于t1、t2、t3、t4分钟后,分别称量剩余质量,记录的有关数据如下表:
反应时间t/min
t1
t2
t3
t4
剩余质量(g)
153.4
151.2
150.7
150.7
试计算:
(1)、计算:参加反应的过氧化氢质量。(2)、另一组同学收集生成的氧气并测量体积,结果发现比理论值大,其原因可能是。
-